Enzyme spielen in vielen Stoffwechselreaktionen als Biokatalysatoren eine große Rolle.
Bestimmte Vorgänge, in welchen Substrate in Produkte umgewandelt werden, werden durch Enzyme beschleunigt oder erst ermöglicht, indem sie die benötigte Aktivierungsenergie heruntersetzen.

Abb.1: Energiediagramm Enzym-Reaktion
Enzyme funktionieren nach dem Schlüssel-Schloss-Prinzip, sind also substrat- und wirkungsspezifisch (bestimmte Enzyme katalysieren die gleiche Umwandlung ihrer Substrate).
Enzymatischen Prozesse können durch die Substratkonzentration, durch die Temperatur, durch eine kompetitive oder allosterische Hemmung beeinflusst werden. Diese vier Möglichkeiten der Beeinflussung werden dir jetzt erklärt.

Substratkonzentration
Mit welcher Geschwindigkeit eine Stoffwechselreaktion abläuft, ist auch von der Konzentration der Ausgangsstoffe, den Substraten, abhängig. Diese Abhängigkeit wird bei enzymkatalysierten Reaktionen mit dem Michaelis-Menten-Diagramm (siehe unten) dargestellt. Bei geringen Substratkonzentrationen ist eine direkte Proportionalität zur Geschwindigkeit zu erkennen. Die Substratkonzentration, bei der die Hälfte der Maximalgeschwindigkeit erreicht wird als
bezeichnet. Aufgrund des Schlüssel-Schloss-Modells ist ab einer bestimmten Substratkonzentration die Substratsättigung erreicht, bei welcher alle Enzymmoleküle mit Substratmolekülen besetzt sind. Somit würde auch eine Erhöhung der Substratkonzentration nicht zu einer höheren Reaktionsgeschwindigkeit führen.

Abb.2: Michaelis-Menten Diagramm
Temperatur
Eine Erhöhung der Temperatur um 10 °C verdoppelt oder verdreifacht die Reaktionsgeschwindigkeit, dies bezeichnet man als RGT-Regel (Reaktionsgeschwindigkeits-Temperatur-Regel), und ist in der Abbildung als RGT-Funktion zu sehen. Diese wird ab einer bestimmten Temperatur von der Inaktivierungsfunktion überlagert, da nun die Hitzedenaturierung der Proteine eintritt. Dabei werden die Bindungen innerhalb des Proteins aufgrund der Wärmeenergie gelöst. Diese Hemmung des enzymatischen Prozesses ist irreversibel, die denaturierten Enzyme können also nicht wieder in ihren ursprünglichen Zustand umgewandelt werden. Das Temperaturoptimum der meisten Enzyme liegt bei der Umgebungs- oder Körpertemperatur, beim Menschen wäre dies bei ca. 37 °C.
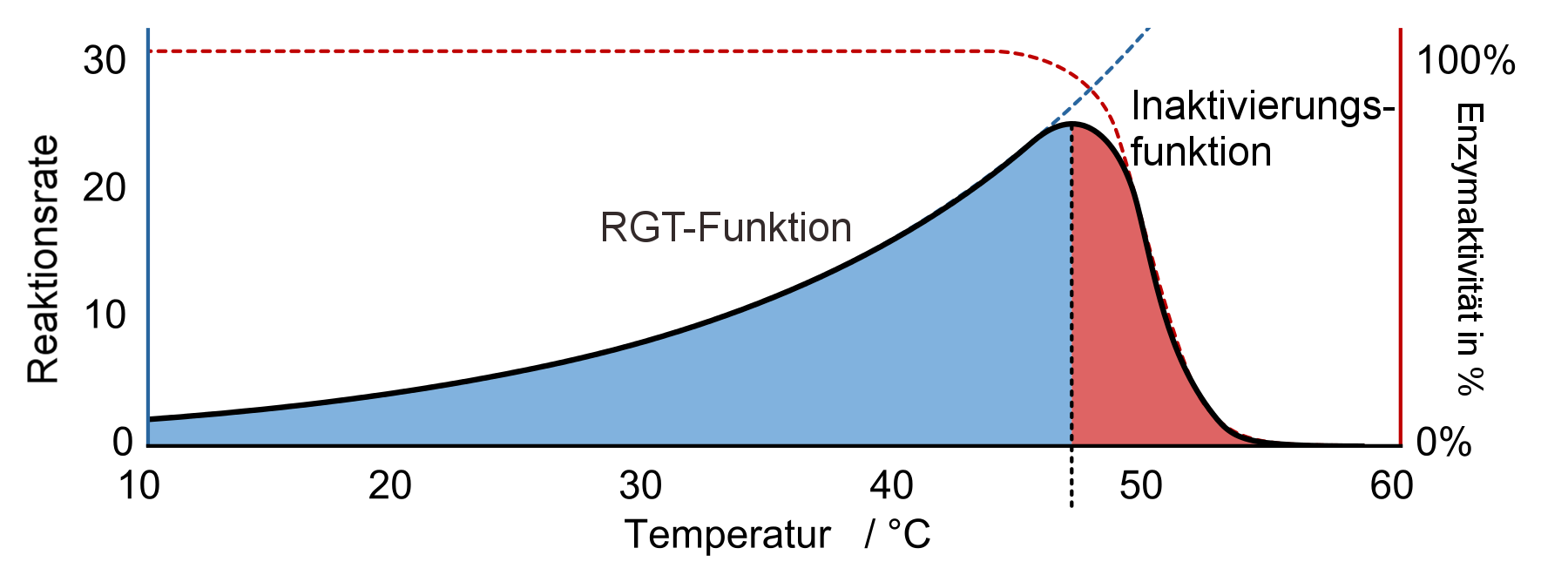
Abb.3: Temperaturabhängigkeit der Reaktionsrate und Enzymaktivität
Kompetitive Hemmung
Um Stoffwechselreaktionen zu regulieren, werden bestimmte Hemmstoffe bzw. Inhibitoren eingesetzt. Wenn dieser Inhibitor ähnlich wie das Substrat strukturiert ist, kann dieser sich anstelle des Substrats an das Enzym binden und somit die Reaktion kurzzeitig hemmen. Dieser Inhibitor verdrängt also das Substrat aus dem aktiven Zentrum des Enzyms. Eine solche kompetitive Hemmung ist reversibel, das bedeutet, sie kann durch eine Erhöhung der Substratkonzentration rückgängig gemacht werden.
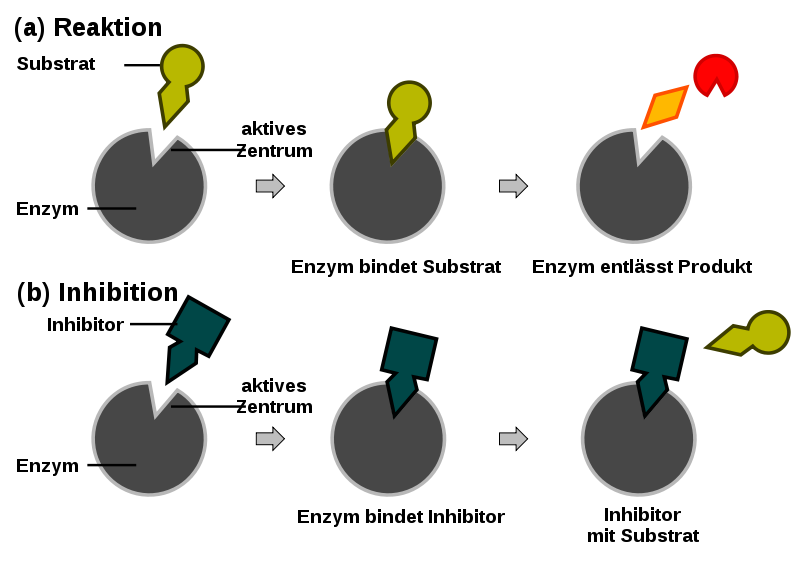
Abb.4: Kompetitive Hemmung eines Enzyms
Allosterische Hemmung
Dahingegen besitzen der Inhibitor und das Substrat bei der nicht-kompetitiven oder allosterischen Hemmung keine ähnlichen Strukturen. Deswegen bindet sich der Inhibitor nicht am aktiven, sondern am allosterischen Zentrum. Durch diese Bindung wird die räumliche Struktur des Enzyms so verändert, dass das Substrat sich nicht an das aktive Zentrum binden kann. Diese Hemmung ist nicht über die Substratkonzentration beeinflussbar. Da solch ein Mechanismus oft zur Regulation des Stoffwechsels benutzt wird, wobei das Endprodukt oder ein Zwischenprodukt dieser Reaktion die Enzyme allosterisch hemmt, wird dies als Endprodukt- oder Rückkopplungshemmung bezeichnet.
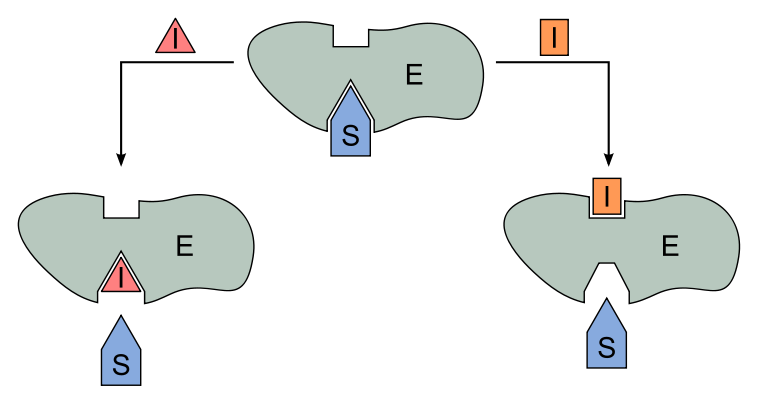
Abb. 5: Kompetitive Hemmung (links) und Allosterische Hemmung (rechts)
Quellen
- Große Teile des Artikels sind in veränderter Form übernommen aus: Brigitte Meinhard, "Abitur-Training: Biologie 1", Stark, 2014, S. 18-22: Abhängigkeit der Enzymaktivität von Außenfaktoren
- Abb.1 : übernommen von Matthias M. aus Wikipedia
- Abb.2 : übernommen von Yikrazuul aus Wikipedia
- Abb.3 : verändert übernommen von Thomas Shafee aus Wikipedia
- Abb.4 : übernommen von Matthias M. aus Wikipedia
- Abb.5 : übernommen von Sponk aus Wikipedia
