Chemische Bindung
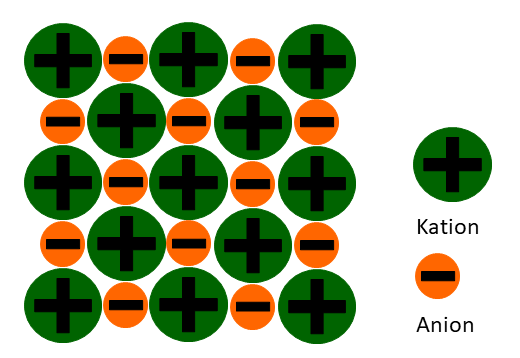
Quelle: Selbsterstellt von WandaPaetzold
Ionische Bindungen
Kovalente Bindungen
Metallische Bindungen
Funktionelle Gruppen
Wechselwirkungen
Dieses Werk steht unter der freien Lizenz
CC BY-SA 4.0 → Was bedeutet das?

Quelle: Selbsterstellt von WandaPaetzold