Die Ionenbindung kommt durch Reaktion von Metallatomen mit Nichtmetallatomen zustande. Das Metallatom gibt dabei seine Außenelektronen (=Valenzelektronen) ab, das Nichtmetallatom nimmt zur Auffüllung der äußeren Schale diese Elektronen auf.
Damit erreichen beide Atome ihre Edelgaskonfiguration.
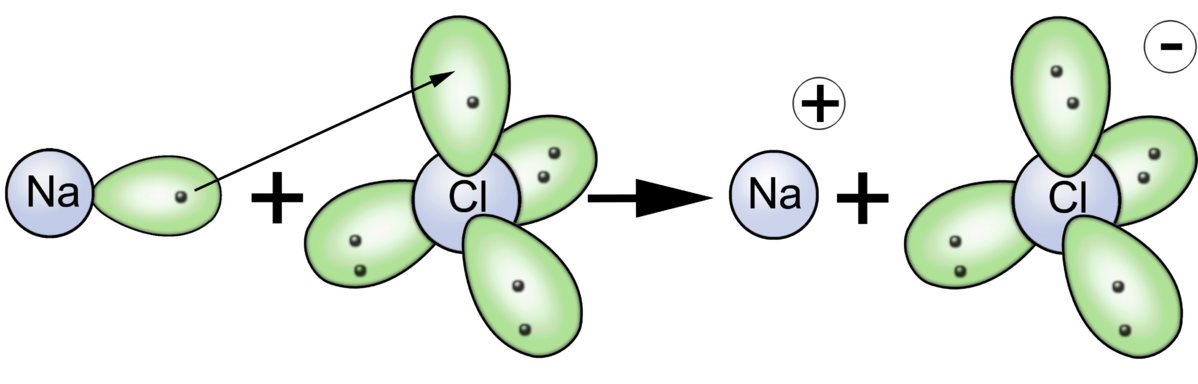
Abb. 1
Es entstehen dabei positiv geladene Ionen (Kationen) und negativ geladene Ionen (Anionen). Diese ziehen sich durch elektrostatische Wechselwirkungen gegenseitig an. Es entsteht ein Ionengitter. Diese werden auch Salzkristall genannt.
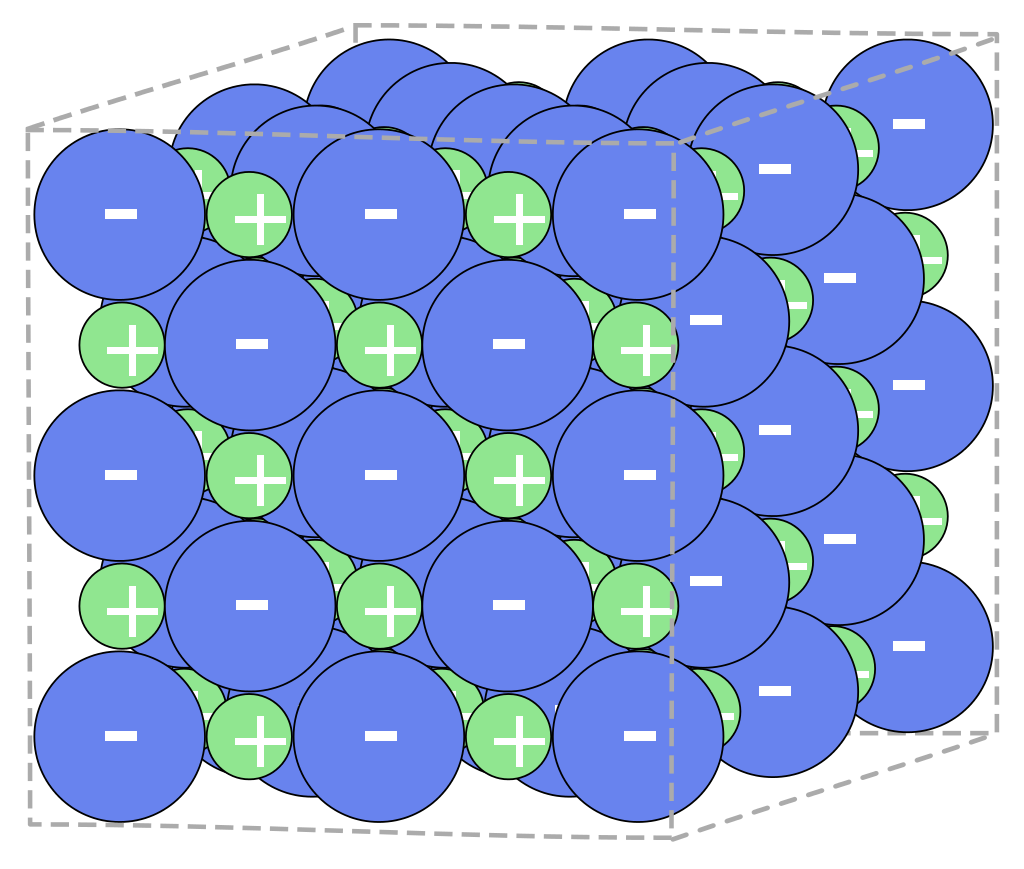
Quelle: Roland.chem, CC BY-SA 3.0, Wikimedia Commons
Obwohl das Ionengitter aus geladenen Teilchen (den Ionen) besteht, ist es nach außen hin ungeladen. Dies lässt sich mit der Verhältnisformel erklären.
Die Verhältnisformel
In einem Salzkristall muss die Anzahl an negativen Ladungen und die an positiven Ladungen in der Summe 0 ergeben. Nur so ist das Salz nach außen hin auch ungeladen.
Die Verhältnisformel gibt das Verhältnis von Metallionen (also positiven Kationen) zu Nichtmetallionen (also negativen Anionen) an.
Beispiele:
Natriumchlorid: (Im Verhältnis 1:1)
Beteiligte Ionen:
Rechnung:
Magnesiumsulfid: (Im Verhältnis 1:1)
Beteiligte Ionen:
Rechnung:
Natriumoxid: (Im Verhältnis 2:1)
Beteiligte Ionen:
Rechnung:
Warum die Ionen unterschiedliche Ladungen haben, kannst du in dem Artikel "Ionenladung" nachlesen.
