Die Ionenladung ist die Anzahl positiver oder negativer elektrischer Ladungen eines Ions.
Die Ionenladung wird durch eine hochgestellte Ziffer mit nachstehendem Plus- oder Minuszeichen angegeben.
Das sieht dann beispielsweise so aus:
das Wasserstoff-Ion hat eine positive Ladung
das Sulfid-Ion hat zwei negative Ladungen
das Phosphat-Ion hat drei negative Ladungen
Bestimmung der Ionenladung
Atomionen
Ionen bilden sich unter anderem deswegen, weil die beteiligten Atome ihren Edelgaszustand erreichen wollen.
Für die Bestimmung der Anzahl an Ladungen gilt:
Metallatome der Hauptgruppenelemente geben alle Außenelektronen ab
Nichtmetallatome füllen ihre Außenschale zum Elektronenoktett auf
Beispiele:
Das Chloratom braucht noch ein Elektron, um den Edelgaszustand zu erreichen. Es entsteht also ein einfach negativ geladenes Chlorid Ion
Das Magnesium Atom muss zwei Elektronen abgeben, um den Edelgaszustand zu erreichen. Es entsteht also ein zweifach positiv geladenes Magnesium Ion.
Molekül Ionen
Molekül Ionen entstehen fast immer aus Säuren, die ihren Wasserstoff in Form von abgespalten haben. Je mehr Protonen von der Säure abgespalten wurde, desto größer ist der Betrag der negativen Ladung.
Beispiele:
Durch das Abspalten von zwei Protonen entsteht ein zweifach negativ geladenes Sulfat Ion
Durch das Abspalten von drei Protonen entsteht ein dreifach negativ geladenes Phosphat Ion.
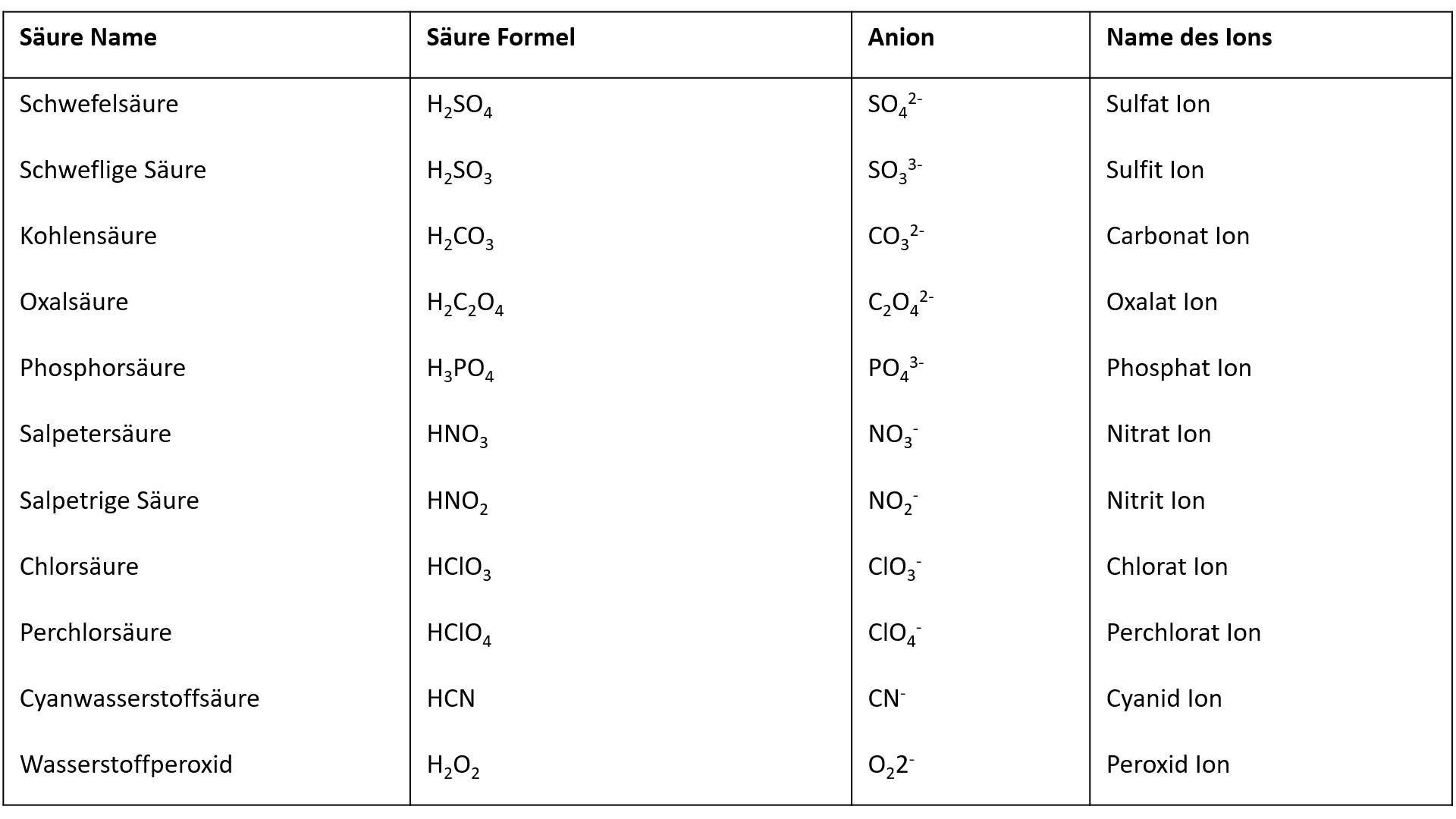
Die Namen und Formeln der Säuren und ihrer Ionen kann man nicht herleiten! Du solltest sie daher am besten auswendig lernen.
