Strukturformeln
Strukturformeln zeigen die räumliche Anordnung von Atomen in Molekülen auf unterschiedliche Art und Weise.
Hier sind die verschiedenen Strukturformeln zusammengefasst.
Elektronenformel
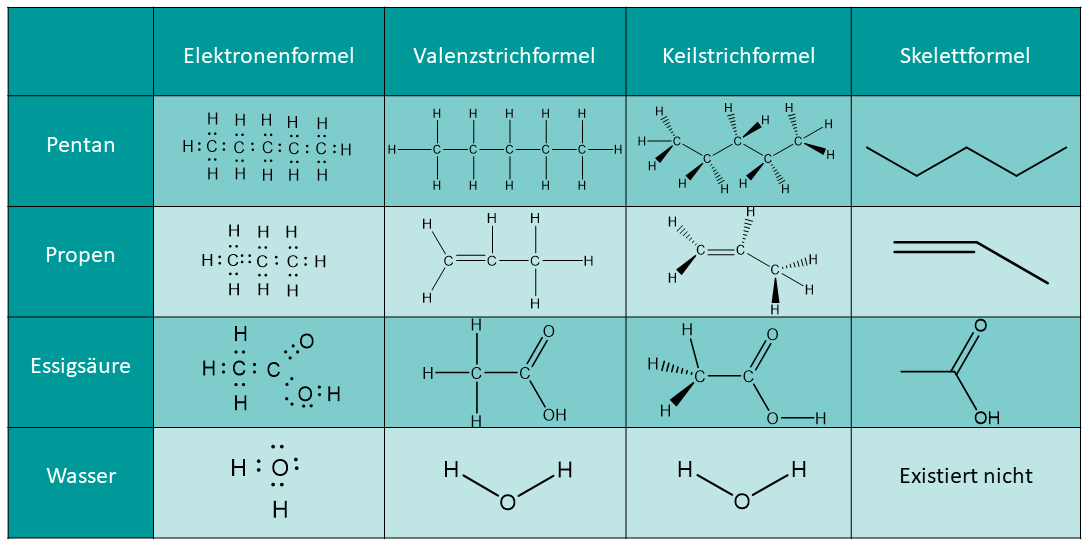
Die Elektronenformel wird auch Lewis-Fromel oder Lewis-Struktur genannt. Sie zeigt alle Valenzelektronen der einzelnen Atome an und wie diese an den Bindungen beteiligt sind oder als freie Elektronenpaare vorliegen.
Im Gegensatz zur Valenzstrichformel werden die Elektronenpaare hier als einzelne Punkte dargestellt und nicht als Strich, welcher für ein Elektronenpaar steht.
Der Vorteil der Elektronenformel ist, dass die Valenzelektronen deutlicher dargestellt sind als in anderen Strukturformeln.
Valenzstrichformel
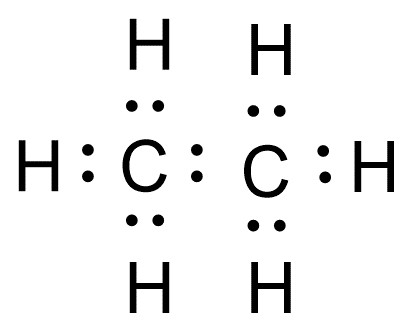
Die Valenzstrichformel stellt den zweidimensionalen Bau von Molekülen dar. Sie wird insbesondere verwendet, um Reaktionsmechanismen, Mesomerien und Tautomerien zu veranschaulichen.
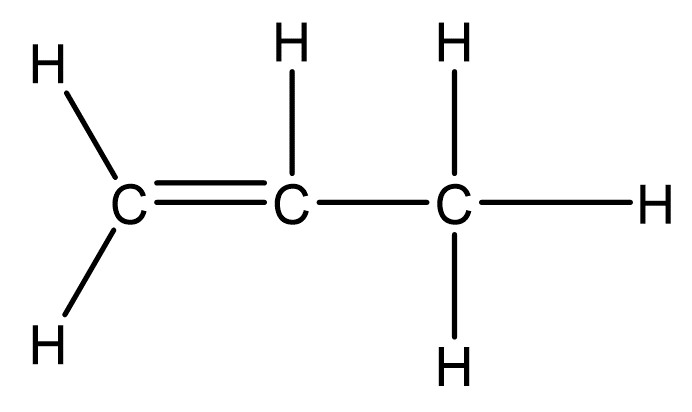
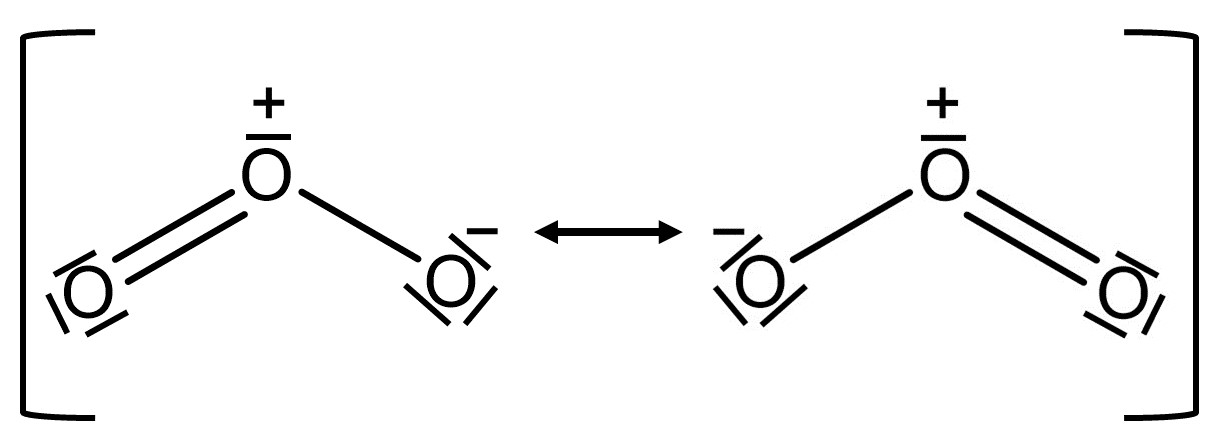
Hier ist die Mesomerie von Ozon () in Valenzstrichformel abgebildet.
Auch hier werden nur Valenzelektronen gezeigt, allerdings wird jedes Valenzelektronen-paar als Strich dargestellt.
Der Vorteil dieser Schreibweise ist, dass alle Valenzelektronen eingezeichnet sind. Diese Schreibweise ist dabei etwas übersichtlicher als die Elektronenformel.
Keilstrichformel
Die Keilstrichformel stellt die dreidimensionale Struktur von Molekülen dar. Dabei zeigen die dreieckigen Keile Atome an, welche im Vordergrund stehen, Gestrichelte Linien zeigen Atome an, welche im Hintergrund stehen und einfache Linien zeigen Atome an, welche auf der Papierebene liegen.
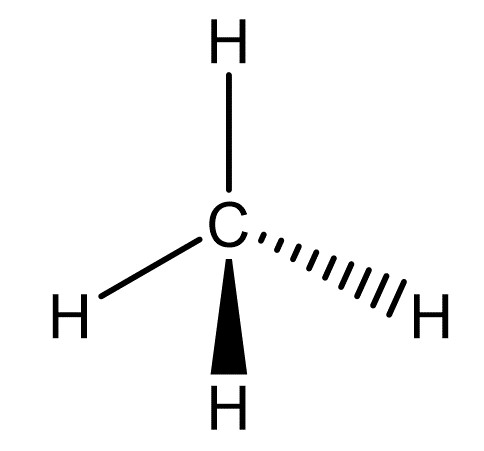
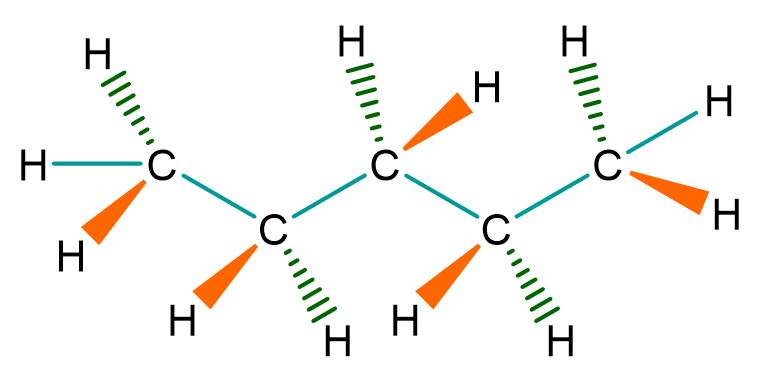
Hier ist die Keilstrichformel von Pentan () abgebildet.
Der Vorteil dieser Darstellung ist, dass die dreidimensionale Struktur sowie die Bindungswinkel zwischen den Atomen dargestellt werden können.
Skelettformel
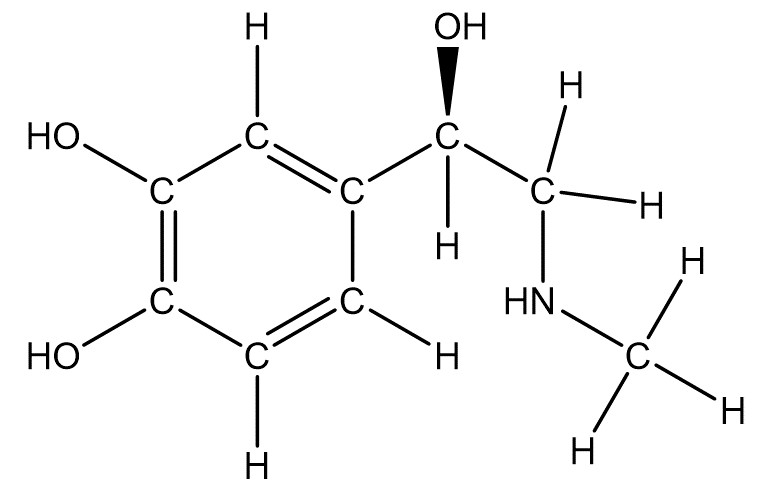
Die Skelettformel ist eine sehr knappe Darstellung einer Strukturformel. Sie wird insbesondere für komplexe chemische Strukturen verwendet, da sie schnell und einfach zu zeichnen ist und dabei nicht überladen aussieht.
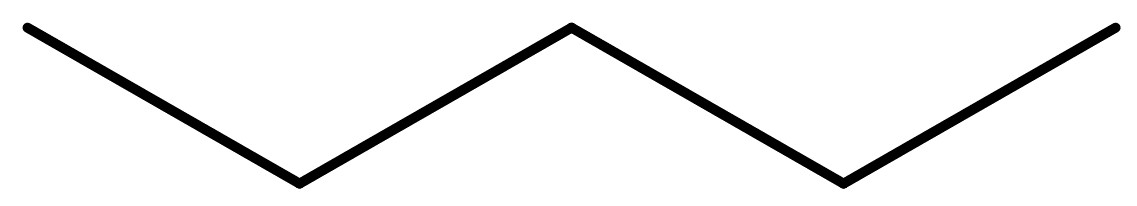
Jede Linie stellt dabei eine Bindung dar. Das bedeutet, dass an den Enden jeder Linie ein C-Atom sitzt. Wasserstoffatome (inkl. Bindung), die an ein C-Atom gebunden sind, werden gar nicht eingezeichnet, Heteroatome (alle nicht C- oder H-Atome) hingegen schon. funktionelle Gruppen können abgekürzt werden (zB. -OH).
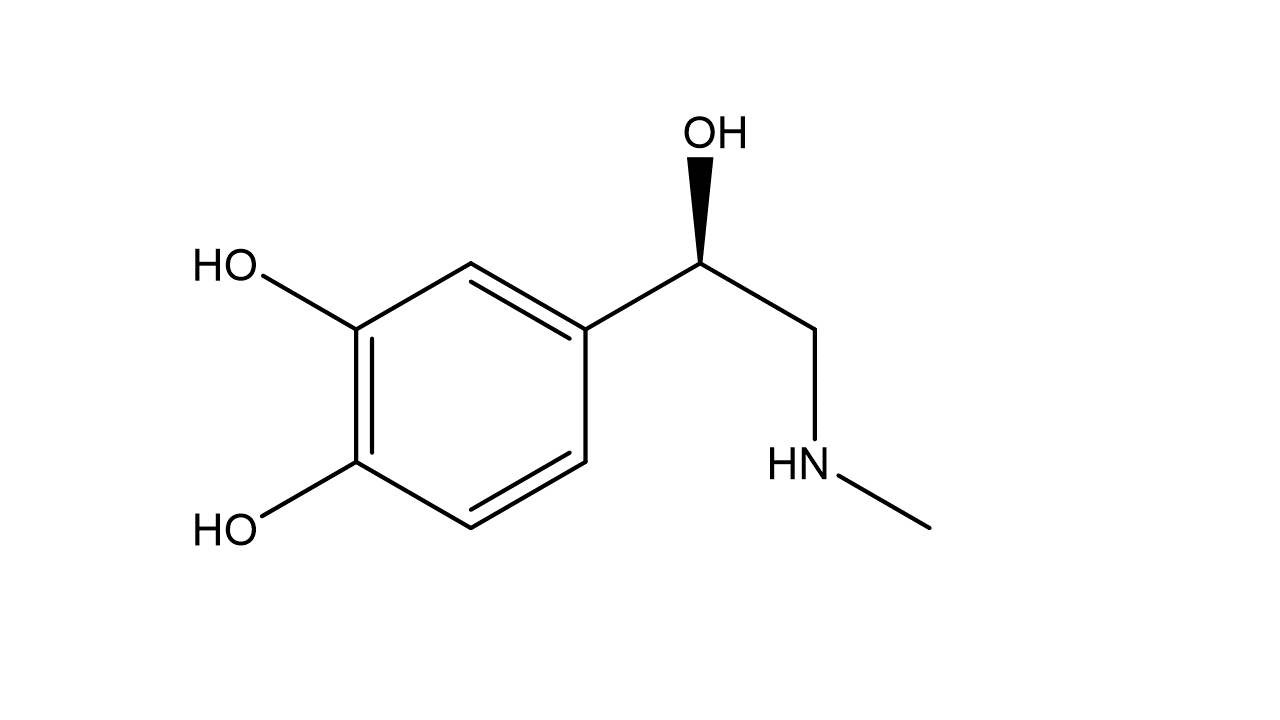
Hier ist Adrenalin abgebildet. Würdest du alle Wasserstoffatome einzeichnen, wäre das sehr unübersichtlich und die wichtige Grundstruktur wäre nicht mehr zu erkennen.
Weitere Darstellungsformen
Weitere Möglichkeiten der Darstellung konzentrieren sich weniger auf die Struktur des Moleküls, sondern mehr auf die Anzahl der Atome.
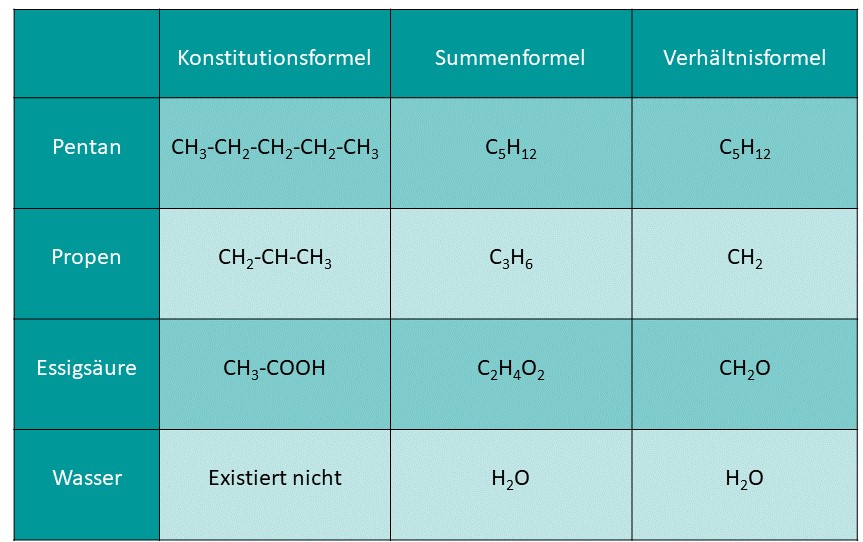
Hier sind weitere Darstellungsformeln zusammengefasst:
Konstitutionsformel
Die Konstitutionsformel zeigt die Bindungen zwischen den C-Atomen eines Moleküls. Sie wird auch Halbstrukturformel genannt, da ein Teil der Struktur erkennbar ist, aber nicht die ganze.
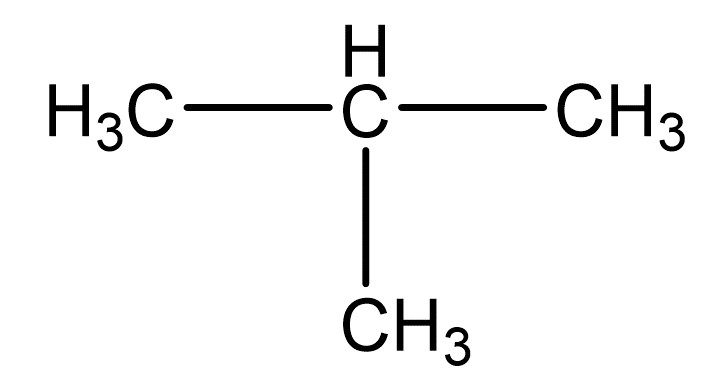
Die Konstitutionsformel wird insbesondere angewendet, wenn die Struktur erkennbar und die Darstellung eher einfach sein soll.
Summenformel
Die Summenformel gibt die Anzahl und Art der Atome in einem Molekül an, ohne Informationen über deren Struktur zu geben.
Das ist die Summenformel von Pentan, sie kann aber auch alle Isomere des Pentans beschreiben.
Die Summenformel wird insbesondere dann verwendet, wenn absichtlich keine Informationen zur Struktur angegeben werden sollen.
Verhältnisformel
Die Verhältnisformel gibt die kleinstmöglichen Zahlenverhältnisse von Atomen in einer chemischen Formel an. Dadurch gibt sie allerdings auch nicht die reale Anzahl der Atome im Molekül an, weshalb sie nicht alleinstehend verwendet werden kann.
Heutzutage wird die Verhältnisformel eigentlich nicht mehr verwendet.
