
In Arbeit …
Während die wissenschaftliche Untersuchung von Atomen ein vergleichsweise junges Gebiet der Physik darstellt, ist die Idee vom Aufbau aller uns umgebenden Materie aus kleinsten „Bausteinen“ sehr alt.
Der Atomismus der Antike
Schon im 5. Jahrhundert v. Chr. vertraten die beiden griechischen Philosophen Leukipp und Demokrit die Lehre vom sogenannten Atomismus. Demnach sei das ganze Universum aus voneinander trennbaren Einheiten von sehr geringem Ausmaß zusammengesetzt. Da man diese nicht weiter zerlegen könne, nannten die beiden Gelehrten sie ἄτομος (átomos, griechisch für "unteilbar"). Diese Auffassung stand im Widerspruch zur Lehre von den Elementen (Platon, 5. Jahrhundert v. Chr.), nach der alle Stoffe eine Mischung aus den Elementen Feuer, Wasser, Luft und Erde darstellten.
Trotz der – vom heutigen Standpunkt aus gesehen – sinnvollen Annahme der Existenz von Atomen hatte der Atomismus bis in die Neuzeit lediglich eine philosophische Bedeutung.
Das Atommodell nach Dalton (1808)
In der zweiten Hälfte des 18. Jahrhundert fand man bei der Untersuchung verschiedener chemischer Reaktionen die folgenden Gesetzmäßigkeiten.
Gesetz von der Erhaltung der Masse: Bei jeder chemischen Reaktion entspricht die Masse aller Ausgangsstoffe der Masse aller Reaktionsprodukte.
Beispiel
Werden reines Magnesium an der Luft verbrannt (es reagiert dabei mit Sauerstoff), entstehen genau Magnesiumoxid:
und
Gesetz der konstanten Proportionen: Elemente (reine Substanzen wie z. B. Stickstoff oder Sauerstoff) bilden unter bestimmten Umständen Verbindungen (z. B. Stickstoffdioxid oder Stickstoffmonoxid) in gewissen, konstanten Massenverhältnissen.
Beispiel
[wird noch eingefügt]
Diese Beobachtungen bewegten den Chemiker John Dalton (1766-1844) dazu, eine modellhafte Vorstellung vom Aufbau der Stoffe zu entwickeln, deren zentrale Aussagen die folgenden sind:
Materie besteht aus (mit chemischen Methoden) nicht weiter zerlegbaren Teilchen, den Atomen. Diese kann man sich in Gestalt von kleinen Kugeln vorstellen.
Charakteristische Eigenschaften von Elementen sind unter anderem Größe und Masse der Atome, das bedeutet beispielsweise, dass Gold- und Eisenatome unterschiedlich schwer oder Silber- und Kupferatome verschieden groß sind.
Bilden Elemente Verbindungen aus, so vereinigen sich die Atome der Ausgangsstoffe (im Falle von Gasen und Flüssigkeiten) zu Molekülen und stehen dabei in ganzzahligen Mengenverhältnissen zueinander.
Dieses einfache Modell ermöglichte neben den oben genannten Aspekten auch eine Interpretation der thermodynamischen Gasgesetze. Nicht erklärbar blieben jedoch vor allem elektrische und magnetische Phänomene.

Abb. 1: Würde man einen Silberlöffel und einen Kupferdraht in ungefähr einhundertmillionenfacher Vergrößerung betrachten, könnte man die atomare Struktur dieser Materialien sehen. Dabei stellt man fest, dass die Atome des Silbers größer sind als die des Kupfers.
Das Atommodell nach Thomson (1904)
Im 19. Jahrhundert entwickelten sich die Naturwissenschaften rasant weiter. Besonders bei der Erforschung der Erscheinungen rund um Elektrizität und Magnetismus machte man gewaltige Fortschritte. Nur waren diese nicht mit der damaligen Vorstellung vom Aufbau der Materie vereinbar.
Ein eindrucksvolles Experiment, das den Physiker J. J. Thomson beschäftigte, zeigte aber, dass man sich offensichtlich mit den elektrischen Eigenschaften von Teilchen zu befassen hatte:
Bei einer Gasentladung beobachtet man die Entstehung geladener Teilchen. In einem elektrischen Feld werden diese so beschleunigt, dass sich ein Strahl – der sogenannte Kathodenstrahl – ausbildet. Gelangt dieser Strahl in ein weiteres, dazu senkrecht orientiertes, magnetisches Feld, zeigen sich Ablenkungen. Auch bei Umpolung des beschleunigenden elektrischen Feldes ist ein Strahl erkennbar, den man als Kanalstrahl bezeichnet. Einerseits registriert man Teilchen, denen man immer dasselbe Verhältnis von Ladung und Masse zuordnen kann. Man nennt diese Teilchen, die den Kathodenstrahl bilden, Elektronen. Andererseits müssen auch positiv geladene Teilchen vorhanden sein, die ein für jedes Gas charakteristisches Verhältnis aufweisen. Diese Teilchen – als Ionen bezeichnet – zeigen sich in der Gestalt des Kanalstrahls.
Abb. 2: Versuchsaufbau zur Beobachtung von Kathodenstrahlen. Elektronen, die bei einer Gasentladung entstehen, werden zur durchlässigen Kathode hin beschleunigt und aufgrund der Lorentz-Kraft im Magnetfeld abgelenkt (Drei-Finger-Regel beachten).
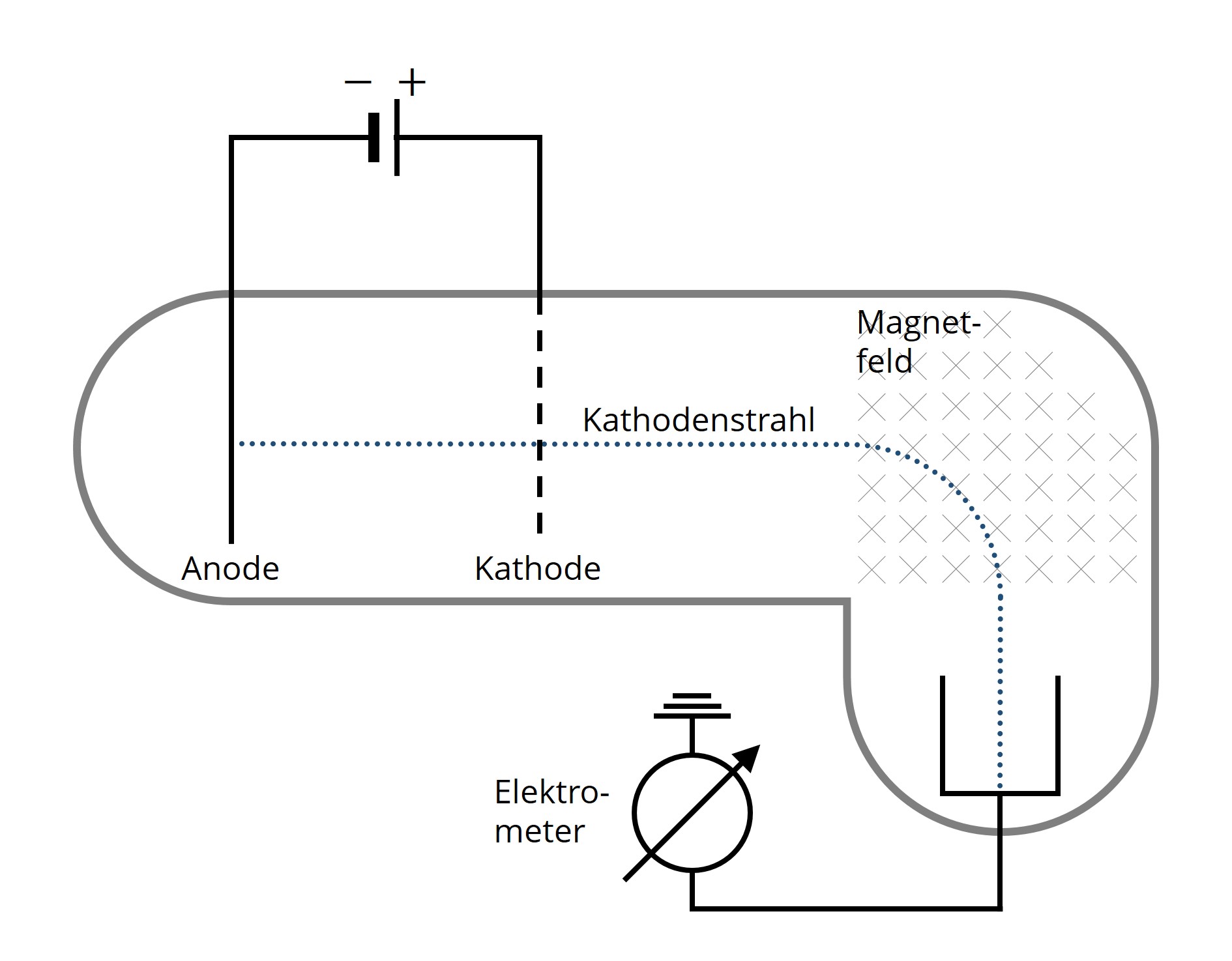
Abb. 2
Abb. 3: Versuchsaufbau zur Beobachtung von Kanalstrahlen. Positiv geladene Ionen, die bei einer Gasentladung entstehen, werden zur durchlässigen Anode hin beschleunigt und aufgrund der Lorentz-Kraft im Magnetfeld abgelenkt (Drei-Finger-Regel beachten).
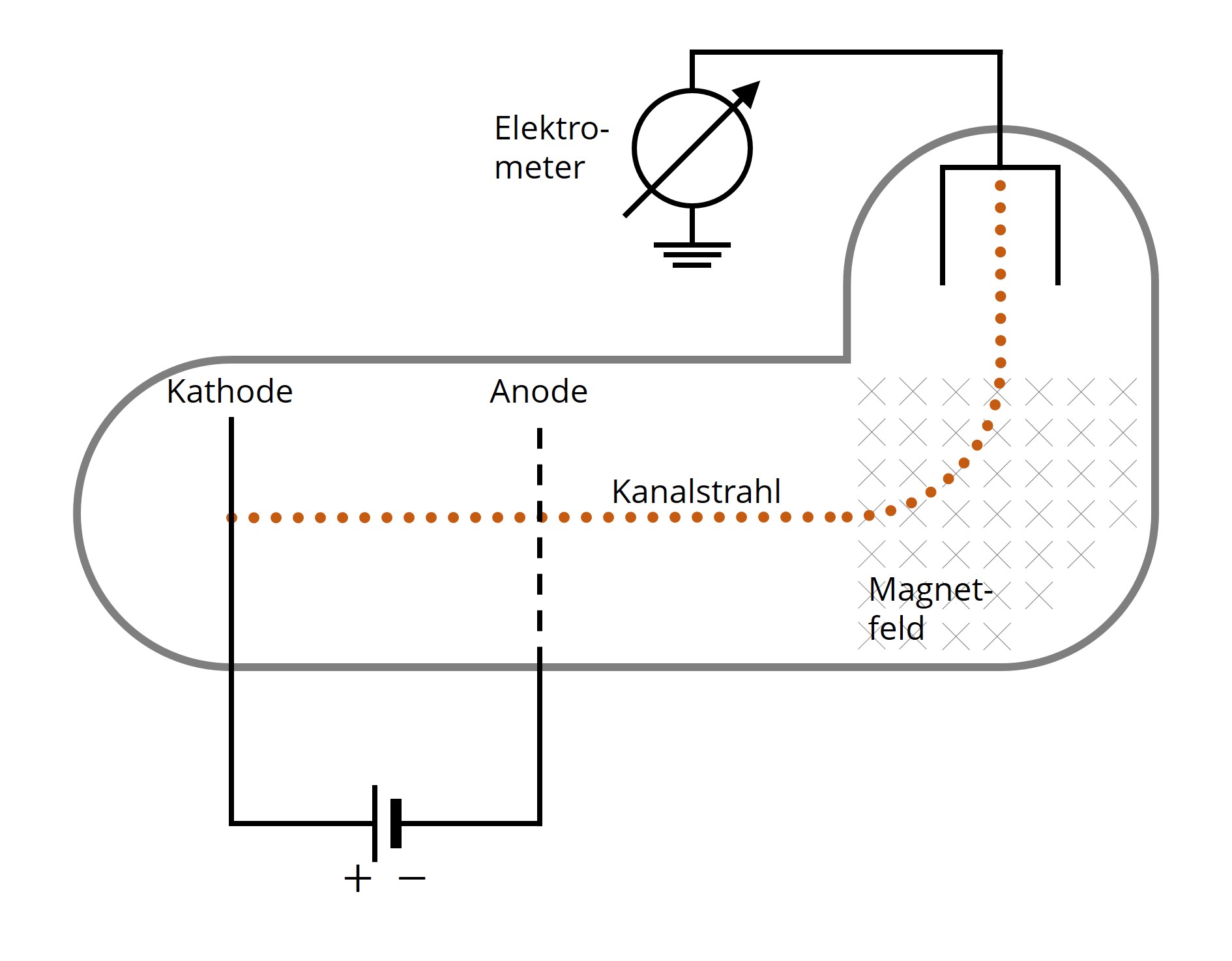
Abb. 3
Thomson schloss daraus, dass Atome folgendermaßen aufgebaut sein müssten:
In eine gleichmäßig (homogen) positiv geladene Kugel sind die negativ geladenen Elektronen regelmäßig eingebettet (man spricht daher auch vom Rosinenkuchen-Modell).
Elektronen weisen in allen Atomen das gleiche Verhältnis von Ladung und Masse auf. Ihre Masse ist – verglichen mit der Gesamtmasse eines Atoms – sehr klein.
Die Anzahl der Elektronen im Atom ist gerade so groß, dass die positive Ladung kompensiert wird, das Atom nach außen hin also elektrisch neutral ist.
Erfahrungen, die man bis zu diesem Zeitpunkt mit Ionisierung und Elektrolyse gemacht hatte, deckten sich mit Thomsons Atommodell. Die Beobachtungen, die man bei der Untersuchung gewisser optischer Erscheinungen macht, können allerdings nicht gedeutet werden, genauso wenig wie die Radioaktivität.
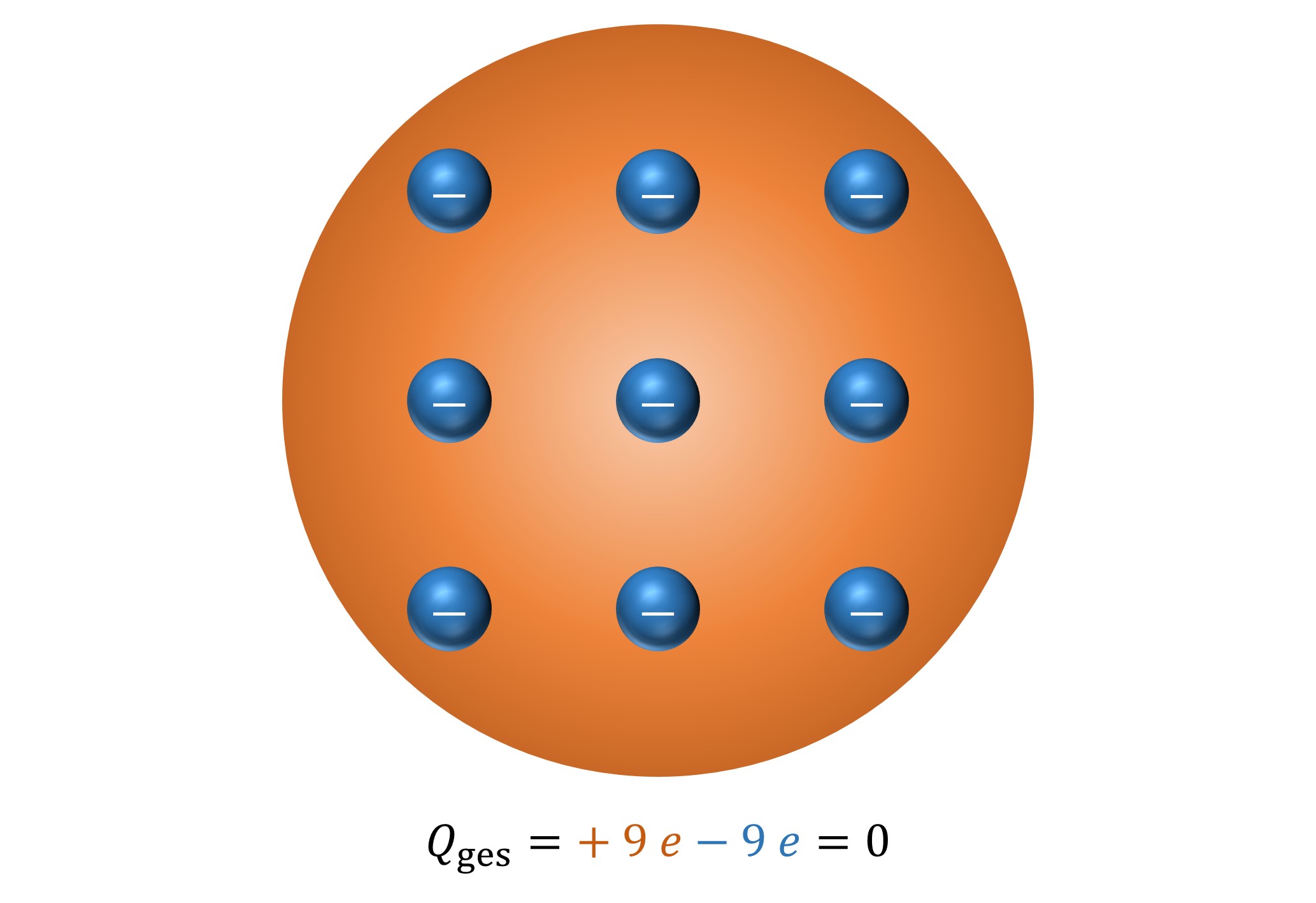
Abb. 4: Das 1904 von J. J. Thomson vorgeschlagene Atommodell hier am Beispiel von Fluor. Man stellt sich eine homogen positiv geladene Kugel (orange) vor, in welche die negativ geladenen Elektronen gleichmäßig eingebettet sind. Insgesamt ist ein Atom elektrisch neutral, da beide Ladungsanteile betragsmäßig übereinstimmen.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
