Isotope haben die gleiche Anzahl Protonen, jedoch unterschiedlich viele Neutronen.
Die Atommassen werden in der Maßeinheit u angegeben. Die Atommasse der Elemente finden wir im Periodensystem. In der Tabelle sind die Atommassen der ersten zehn Elemente des Periodensystems mit zwei Nachkommastellen aufgelistet:
Atomsorte | H | He | Li | Be | B | C | N | O | F | Ne |
|---|---|---|---|---|---|---|---|---|---|---|
Masse [u] | 1,01 | 4 | 6,94 | 9,01 | 10,81 | 12,01 | 14,01 | 16,00 | 19,00 | 20,18 |
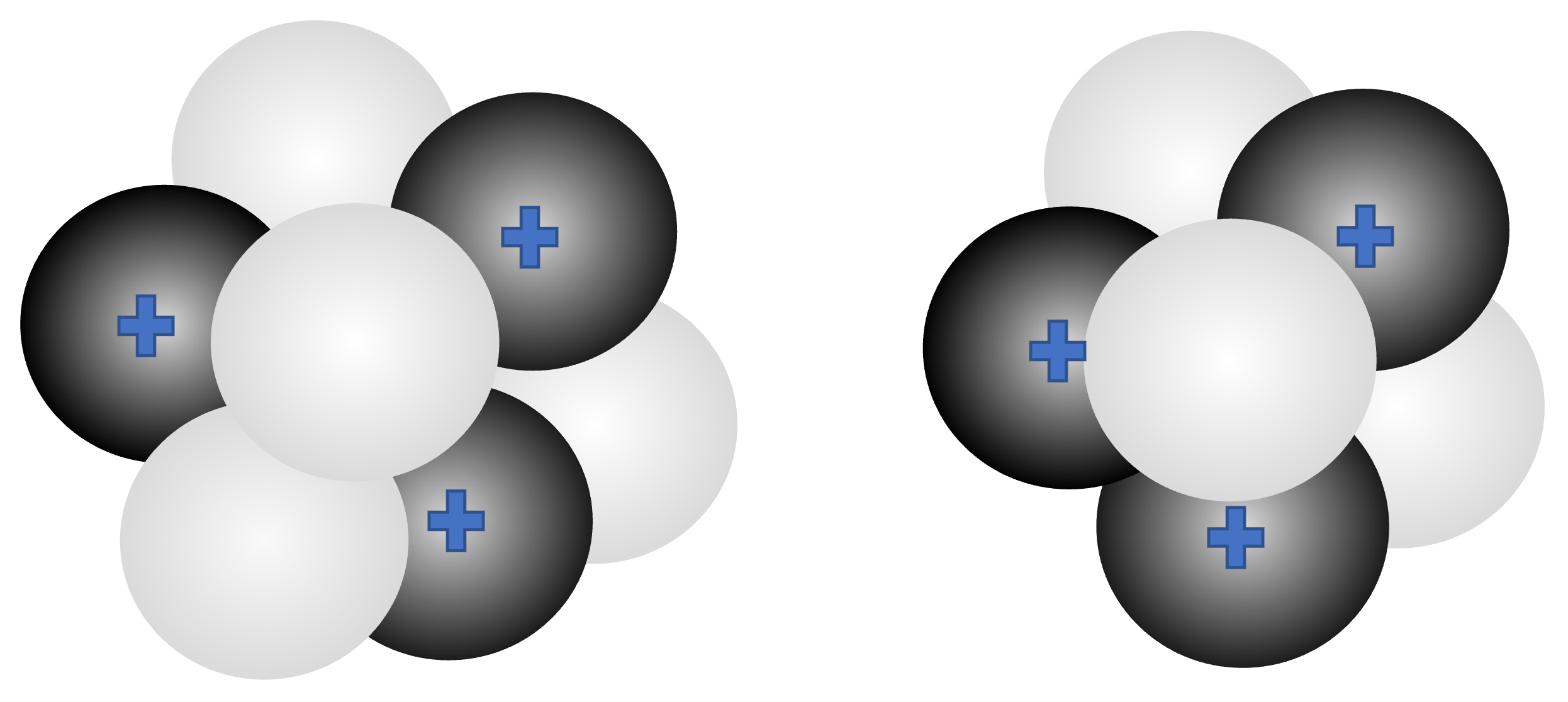
Es fällt auf, dass die Massen für die Atome dieser Elemente gebrochene Werte besitzen. Einer der Gründe dafür ist, dass nicht alle Atome eines Elements die gleiche Masse haben. Die Kerne aller Atome eines Elementes haben zwar immer die gleiche Protonenzahl, können aber unterschiedlich viele Neutronen enthalten. Diese verschiedenen Atome nennen wir Isotope des Elements. Ein Isotop ist also ein Atom mit der gleichen Ordnungszahl (= Protonenzahl), aber unterschiedlicher Neutronenzahl und damit unterschiedlicher Atommasse. Wenn wir generell Atome mit einer bestimmten Neutronenzahl meinen, nennen wir diese auch Nuklide.
Mit unserer bisherigen Schreibweise des Element-Symbols ist das Atom (und damit das Element) zwar definiert, wir wissen aber nicht, um welches Isotops sich handelt. Damit wir Isotope und generell Nuklide genau beschreiben können, braucht es also noch eine weitere Schreibweise. Dafür wird die Anzahl Neutronen und Protonen (Nukleonenzahl) links des Symbols hochgestellt geschrieben. Da diese Zahl auch die Masse des Nuklids ausmacht (die Elektronen sind ja so leicht!), wird sie auch als Massenzahl bezeichnet. Sie wird oft mit dem Buchstaben A bezeichnet. Manchmal wird auch die Ordnungszahl (also Protonenzahl; Zeichen: Z) noch tiefgestellt links dazugeschrieben. Dies ist allerdings redundant (nicht nötige Information, da sie ja schon im Elementsymbol steckt).
Im Periodensystem ist die Atommasse angegeben, welche der durchschnittlichen Atommasse aller natürlich vorkommenden Isotope entspricht. Die meisten Elemente sind keine Reinelemente, sondern „Mischelemente“. Das heißt, in der Natur kommen mehrere Isotope vor. Ein Beispiel für ein Mischelement ist das Bor:
B bzw. B
Die im PSE aufgeführte Atommasse von 10.8 u gibt die durchschnittliche Atommasse dieses Isotopengemisches an. Bor besteht also zu etwa 20 % aus B (auch Bor-10 genannt) und zu 80 % aus B (auch Bor-11 genannt). Die durchschnittliche Atommasse von Bor lässt sich aus den prozentualen Anteilen der verschiedenen Bor-Isotope berechnen:
0.20 · 10 u + 0.80 · 11 u = 10.8 u
Manche Elemente bestehen nur aus einer einzigen Isotopensorte. Diese werden „Reinelemente“ (nicht zu verwechseln mit dem Begriff „Reinstoff“!). Ein Beispiel ist das Aluminium.
Übungsaufgaben
Laden
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
