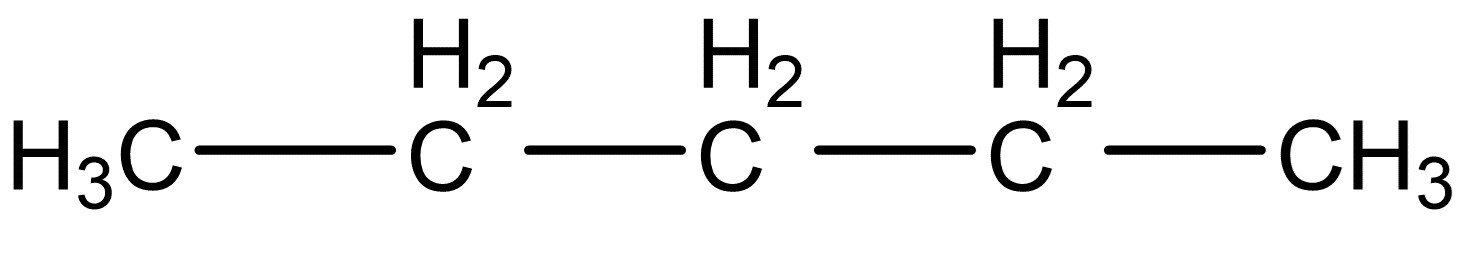
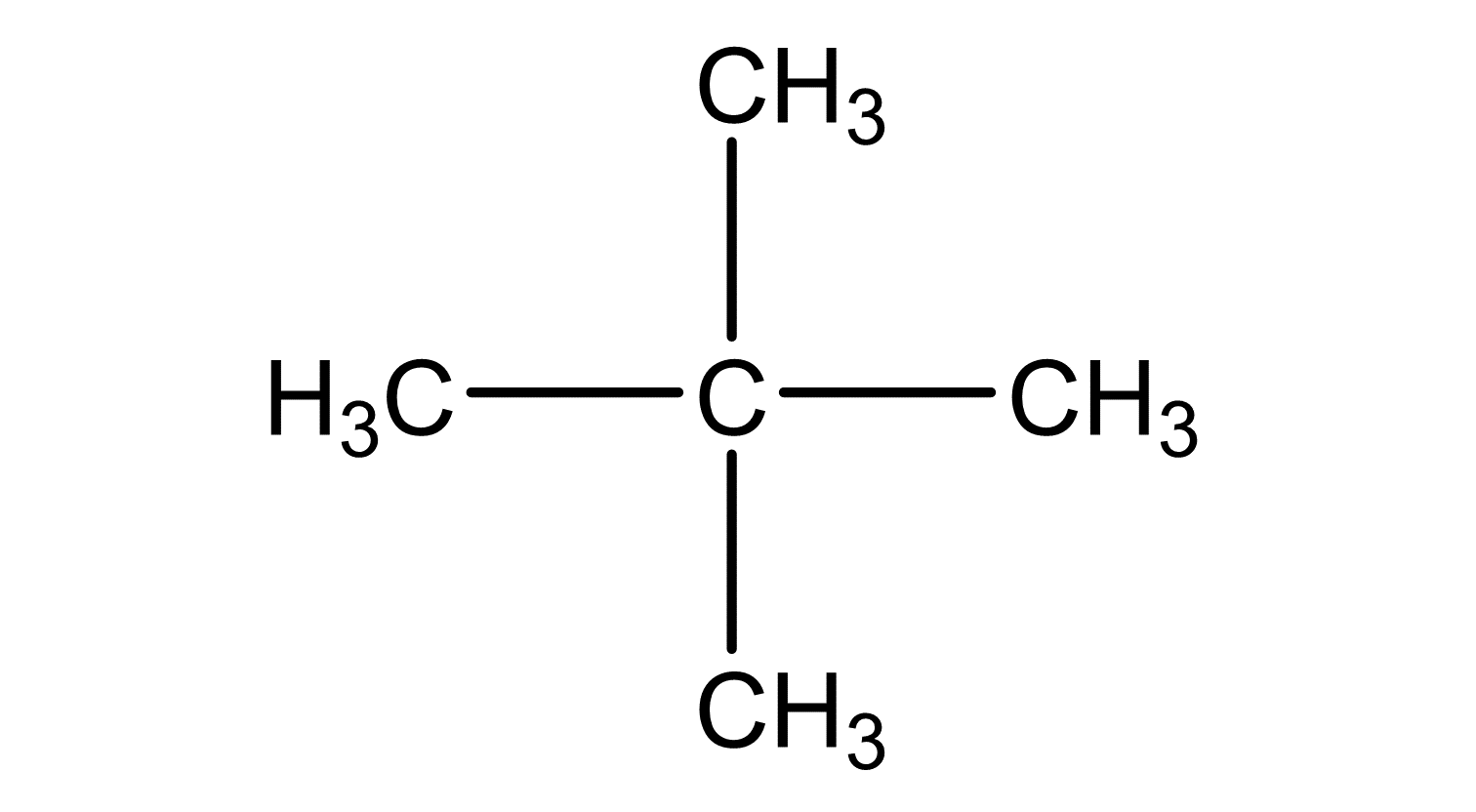
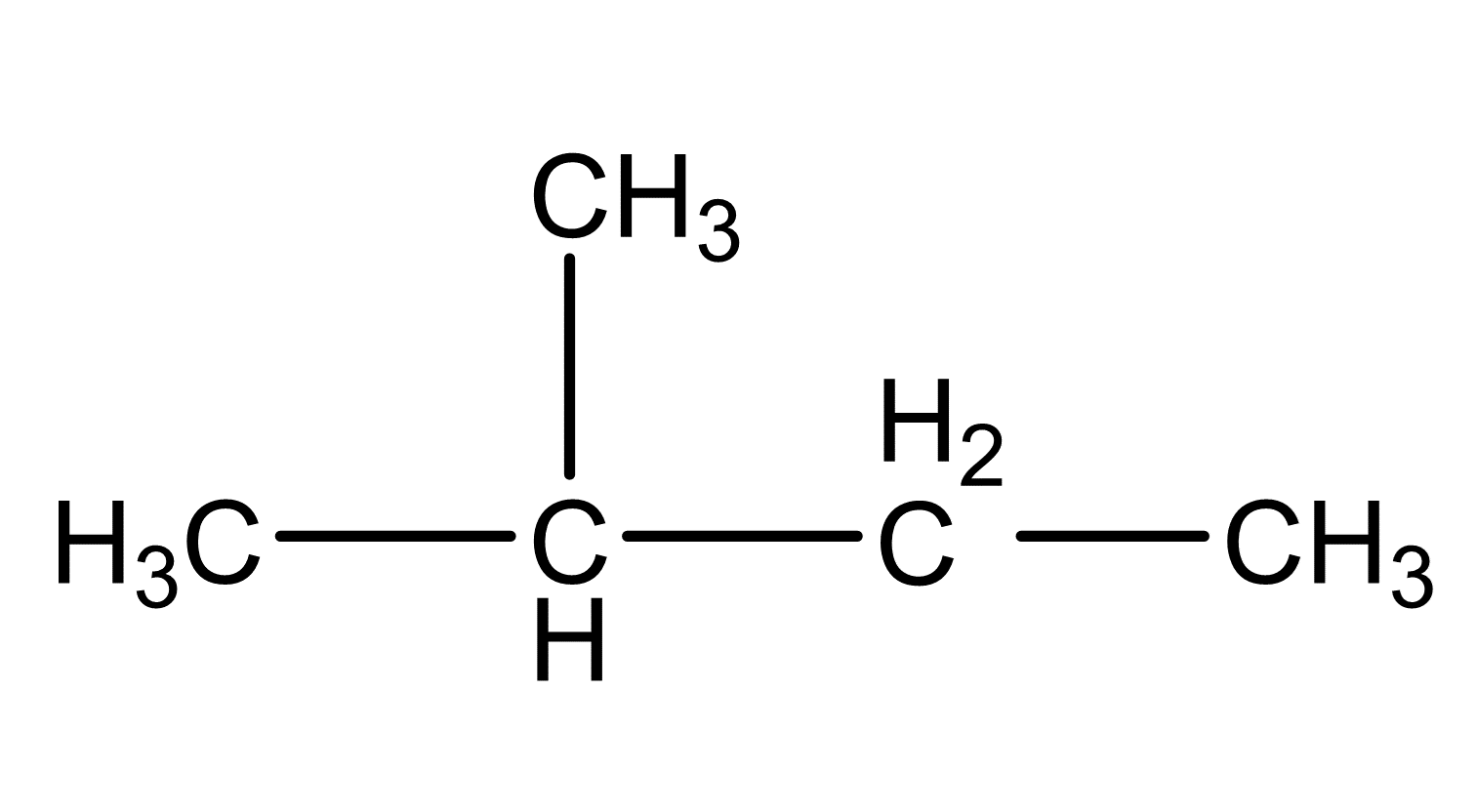
Nachdem du die Valenzstrichformeln für die einzelnen Moleküle gezeichnet hast, musst du zunächst herausfinden, welche zwischenmolekulare Kräfte bei den Pentan-Isomeren vorherrschen.
Bei Kohlenwasserstoffen gibt es immer die Van-der-Waals-Kräfte, da es immer zu einer temporären Verschiebung der Ladungsschwerpunkte kommt. Wasserstoffbrückenbindungen dagegen gibt es nicht, da die Moleküle keine freien Elektronenpaare besitzen.
Um herauszufinden, ob es Dipol-Dipol-Wechselwirkungen gibt, musst du wissen, ob ein Dipol vorliegt. Also bestimmst du die Elektronegativitäten der einzelnen Atome, nämlich hat das Kohlenstoff-Atom eine Elektronegativität von 2,5 und das Wasserstoff-Atom eine Elektronegativität von 2,2. Die Differenz dieser beiden Elektronegativitäten beträgt nur 0,3, weshalb die Moleküle nicht polar sind und auch keinen Dipol besitzen.
Jetzt weißt du also, dass in den Molekülen nur die Van-der-Waals-Wechselwirkungen vorherrschen können. Je größer die Van-der-Waals-Kräfte, desto größer ist die Moleküloberfläche. Eine größere Oberfläche bedeutet größere Van-der-Waals-Kräfte und dadurch wird der Siedepunkt größer.
Das Pentan-Molekül hat insgesamt die größte Oberfläche, deswegen hat es auch von allen Molekülen den größten Siedepunkt, nämlich den bei 36°C.
Von allen 3 Molekülen besitzt das 2,2-Dimethylpropan die kleinste Oberfläche, somit hat es auch den kleinsten Siedepunkt, nämlich den bei 9,5°C.