Symbole der Elemente
Symbole sind international, die Chemiker der ganzen Welt verständigen sich mit global eindeutigen Zeichen. Jedem Element ist eine Abkürzung zugeordnet. Die chemischen Symbole werden unter anderem abgeleitet von lateinischen bzw. griechischen Worten.
Die heute noch gebräuchlichen Symbole gehen auf den schwedischen Chemiker Jöns Jakob Berzelius (1779 - 1848) zurück.
Seine chemische Zeichensprache im Jahre 1818 in einer umfangreichen Tabelle veröffentlicht, ermöglicht es auf einfache und eindeutige Weise, den Aufbau der Verbindungen anschaulich darzustellen.

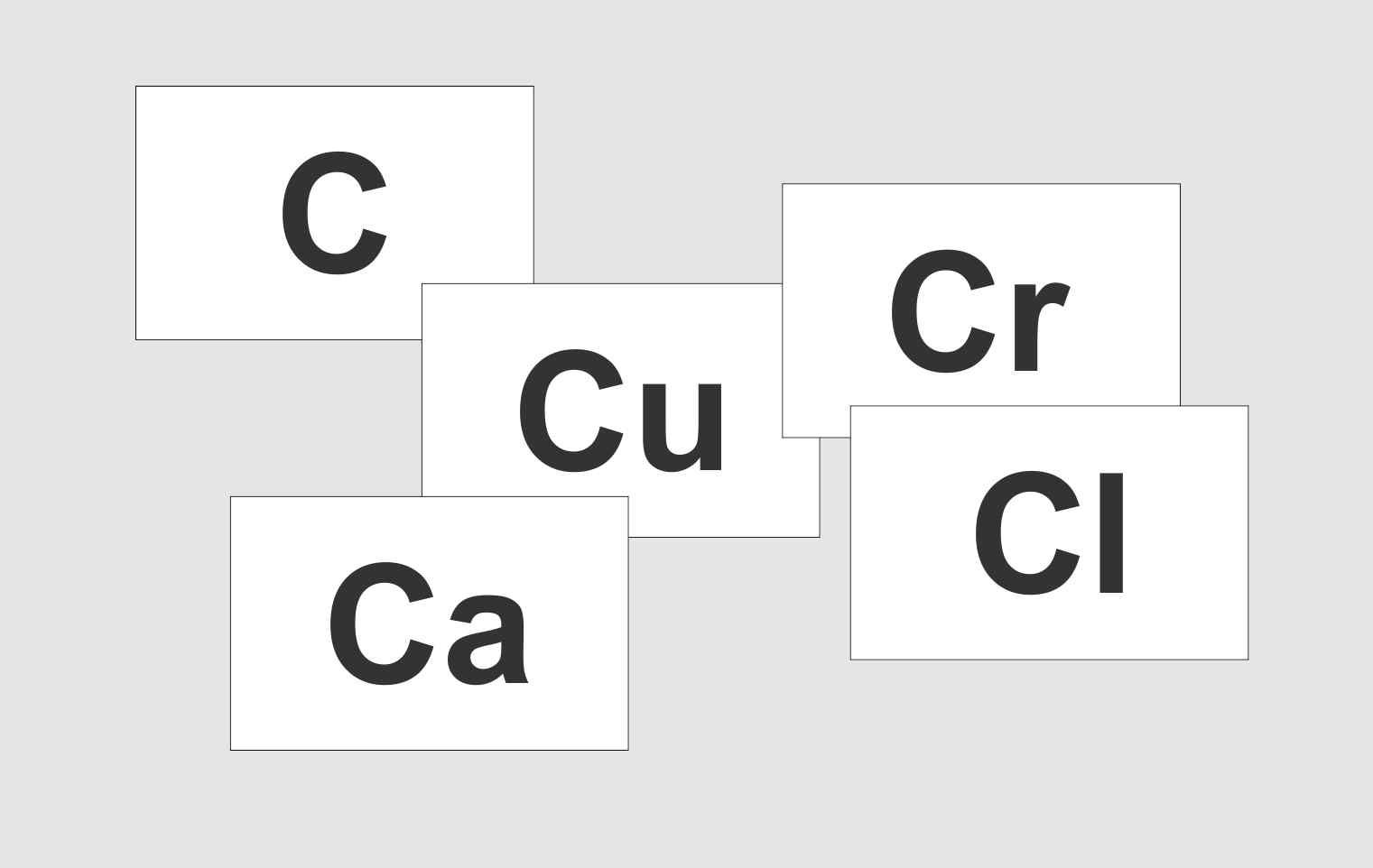
Als Zeichen für jedes Element wird der Anfangsbuchstaben des lateinischen bzw. griechischen Namens gewählt, sollten zwei Elemente mit dem gleichen Buchstaben beginnen, wird ein zweiter hinzugefügt.
So können die Elemente Kohlenstoff, Chlor, Kupfer, Calcium, Chrom eindeutig bezeichnet werden.
Symbole und Formeln
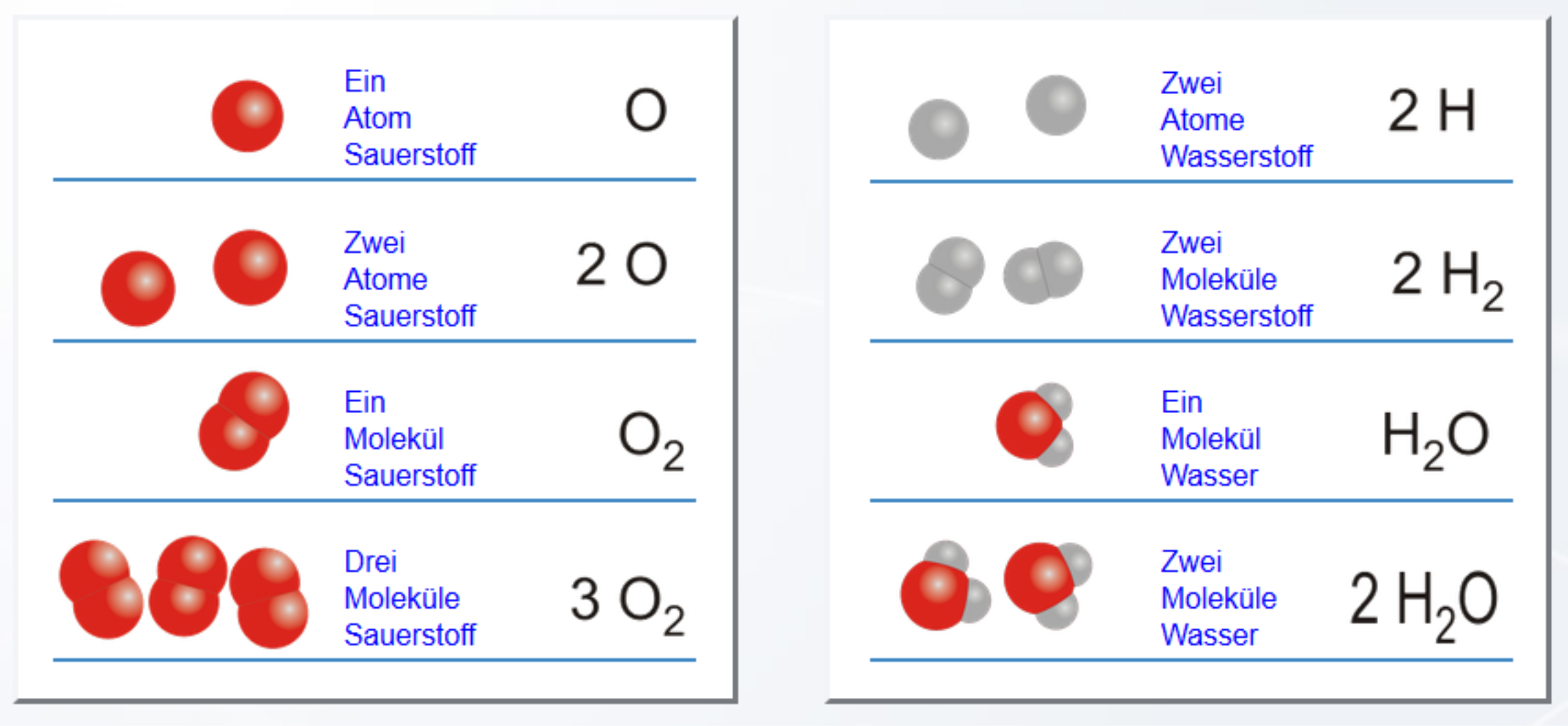
O, das Symbol für Sauerstoff, kennzeichnet das Element und steht für ein Atom des Gases. In einem Sauerstoffmolekül sind zwei Atome verbunden, die Schreibweise lautet "O zwei".
Wichtig ist also, ob eine Zahl vor dem Symbol als stöchiometrischer Koeffizient () steht oder in kleiner Schreibweise unten hinter dem Symbol als Index () verwendet wird:
Verhältnis- und Molekülformeln
Wenn sich Elemente verbinden, dann tun sie dies in einem festen Verhältnis und bilden Moleküle.
Zum Beispiel verbinden sich Kohlenstoff und Sauerstoff in einem festen Verhältnis zu Kohlendioxid.
Hier reagieren Kohlenstoff und Sauerstoff im Verhältnis 1:1 aber die chemische Zusammensetzung ist im Verhältnis 1:2, wenn man die Molekularformel von Kohlendioxid betrachtet.
Die Verhältnisformel gibt an, in welchem Verhältnis die Ionen in einem Ionengitter stehen.
Beispiel: Das Verhältnis ist 2:3
Die Molekülformel (Summenformel) gibt an, wie viele Atome der einzelnen Elemente in einem Molekül vorhanden sind.
Beispiel: Ein Molekül aus zwei Wasserstoffatomen und einem Sauerstoffatom
