Dieser Artikel ist noch in Bearbeitung!
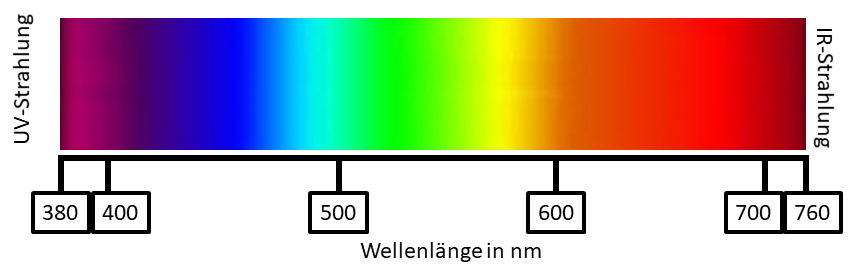
Farbe ist ein durch das Auge aufgenommener und durch das Gehirn verarbeiteter Sinneseindruck, welcher durch einfallendes Licht hervorgerufen wird. Um genauer zu sein, führt die Wahrnehmung der elektromagnetischen Strahlung mit Wellenlängen zwischen 380 und 760 nm zum Farbeindruck.
Licht mit Wellenlängen kleiner als 380 nm ist nicht mehr sichtbar. Den daran angrenzenden Spektralbereich nennt man UV-Bereich. Diesen kennst du vielleicht, denn UV-Licht ist das Licht, welches uns im Sommer bräunt.
Licht mit Wellenlängen höher als 760 nm ist ebenfalls nicht mehr sichtbar. In dem daran angrenzenden Spektralbereich spricht man von IR-Strahlung oder Infrarotstrahlung. Diese findet man zum Beispiel in Wärmelampen.
Da oft von einer "energetischen Anregung" eines Moleküls gesprochen wird, hast du dich vielleicht schon gefragt, wie die Energie mit der Wellenlänge zusammenhängt. Für ein einzelnes Photon der Wellenlänge gilt folgender Zusammenhang:
Hierbei beschreibt h das Planck'sche Wirkungsquantum, , und c die Lichtgeschwindigkeit, . Die Energie wird in der Einheit Joule angegeben.
Falls für das Photon eine Frequenz (oder f) angegeben ist, so kann man über den Zusammenhang die Energie berechnen via
ABSORPTION und EMISSION
Je nach Struktur eines chemischen Moleküls kann es vorkommen, dass dieses einfallende Strahlung absorbiert. Dabei erhöht sich die Gesamtenergie des Moleküls um . Das Photon ist danach nicht mehr vorhanden. Als Formel könnte man dies schreiben als
*
Dabei bezeichnet * das energetisch angeregte Molekül. Bei der Absorption können jedoch nicht Photonen beliebiger Energien aufgenommen werden. #ERGÄNZEN
Andersherum kann es vorkommen, dass ein bereits angeregtes Molekül ein Photon aussendet (= emittiert) um in einen energetisch günstigeren Zustand überzugehen. Das Molekül im Zustand muss jedoch nicht im Grundzustand sein! Man schreibt auch:
*
Bei der Emission werden jedoch nur Photonen bestimmter Energien ausgesandt, wobei diese genau der Energiedifferenz zwischen den zwei Zuständen * und entspricht.
