1 1. Wie schnell sind Chemische Reaktionen?
Rosten von Eisen und die Explosion von Dynamit sind beides chemische Reaktionen. Wie schnell die Reaktionen ablaufen, ist aber höchst unterschiedlich. Chemische Reaktionen sind in unserem Alltag allgegenwärtig und die Reaktionsgeschwindigkeit kann entscheidend sein. So sind auch das Verderben oder Kochen von Lebensmittel chemische Reaktionen, bei denen wir versuchen die Reaktionsgeschwindigkeit zu beeinflussen.
2 2. Messung der Reaktionsgeschwindigkeit
Bei Geschwindigkeit denken wir meistens an die Änderung der Strecke proZeiteinheit (km/h). Bei einer Chemischen Reaktion ändert sich eine andere Grösse, die Edukte werden zu Produkten. Wir wollen also messen, wie schnell Produkte gebildet werden und Edukte aufgebraucht.
Betrachten wir die Reaktion von Magnesium mit Salzsäure:
Um die Reaktionsgeschwindigkeit zu messen, müssen wir messen können, wie sich Edukte und Produkte während der Reaktion verändern.
Aufgabe: Stoppe während dem Experiment die Zeit und notiere die Zeit bei jeweils 5 ml Volumenzunahme. Die Werte werden in eine Tabelle eingetragen.
3 2.1. Halbwertszeit
Im Experiment haben wir gesehen, dass die Reaktionsgeschwindigkeit nicht konstant ist. Das macht es schwierig, Reaktionsgeschwindigkeiten zu vergleichen. Deshalb gibt man oft die sogenannte Halbwertszeit an. Die Halbwertszeit gibt an, zu welcher Zeit die Hälfte der Teilchen reagiert hat.
Beispiele für Halbwertszeiten chemischer Reaktionen:
(Anfangskonzentration 0.1 mol/L)

4 3. Beeinflussung der Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit kann durch verschiedene Faktoren beeinflusst werden.
Temperatur
Je höher die Temperatur ist, desto schneller sind die Teilchen. Das heißt:
- Es gibt mehr Zusammenstöße.
- Die Zusammenstöße sind heftiger und führen öfter zu einer Reaktion.
Im Alltag können wir das gut beobachten. So werden Kartoffeln in einem Dampfkochtopf etwa 4 Mal schneller gar als in einem normalen Topf, weil im Dampfkochtopf Temperaturen von 120 °C erreicht werden. Das sind rund 20 °C mehr als in kochendem Wasser. Die RGT-Regel, eine Faustregel der Chemie, besagt, dass eine Erhöhung um 10 K die Reaktionsgeschwindigkeit verdoppelt. Das Beispiel des Dampfkochtopfs bestätigt das.
1.2. Konzentration
Die Konzentration gibt die Stoffmenge pro Volumen an [mol/L]. Je höher die Konzentration, desto eher stoßen die Teilchen aufeinander und somit verläuft die Reaktion schneller. Wenn die Konzentration im Verlauf einer Reaktion abnimmt, nimmt also auch die Reaktionsgeschwindigkeit ab.
Die Wahrscheinlichkeit, dass die Teilchen zusammenstoßen, ist proportional zur Konzentration. Für eine Reaktion aus Teilchen A und B können wir folgendes Geschwindigkeitsgesetz aufstellen, wobei c die Konzentration ist:
Die Geschwindigkeitskonstante k gibt die Reaktivität der Edukte an. Diese Konstante muss gemessen werden. Da sich die Reaktionsgeschwindigkeit mit der Temperatur ändert, ändert sich auch die Konstante k.
1.3. Oberfläche und Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit hängt davon ab, wie stark etwas verkleinert wird. Das kennen wir auch aus dem Alltag, je feiner wir den Kaffee mahlen, desto stärker wird er. Wenn wir ein Feuer entfachen möchten, geht das einfacher mit feinem Kleinholz als mit großen Scheiten.
Wenn etwas zerkleinert wird, vergrößert sich gleichzeitig auch die vorhandene Oberfläche. Am Beispiel eines Würfels kann das einfach gezeigt werden:

Aufgabe 1: Berechne jeweils das gesamte Volumen und die gesamte Oberfläche, wenn der unzerteilte Würfel eine Kantenlänge von 2cm hat.
Reaktionen finden immer an der Oberfläche statt, weil dort die verschiedenen Teilchen aufeinandertreffen.
Aufgabe: Schau dir nochmals das Diagramm der Reaktionsgeschwindigkeit von Magnesium und Salzsäure an. Warum nimmt die Reaktionsgeschwindigkeit während der Reaktion ab?
Aufgabe: Wie viel länger ist etwas im Kühlschrank (4° C) haltbar als bei Raumtemperatur (24 °C)?
5 Kollisionstheorie
Die Kollisionstheorie ist eine einfache Theorie, um die Reaktionsgeschwindigkeit anschaulich zu erklären. Die Teilchen werden dazu als starre Körper angesehen, die sich bewegen. Wenn die Teilchen zusammenstoßen, erfolgt eine chemische Reaktion. Je öfters und je heftiger die Teilchen zusammenstoßen, desto schneller ist die Reaktion. Damit es eine Reaktion gibt, müssen die richtigen Teilchen mit genügend Energie zusammenstoßen. Nicht alle Teilchen bewegen sich gleich schnell und nicht jeder Zusammenstoß führt zu einer Reaktion.
Wir betrachten dafür die Reaktion von Wasserstoff und Sauerstoff. Stoßen Wasserstoffmoleküle und ein Sauerstoffmolekül mit genügend Energie zusammen, reagieren Sie zu Wassermolekülen. (

Was passiert, wenn zwei Wasserstoffmoleküle zusammenstoßen?
Erkläre mit der Kollisionstheorie und den Abbildungen die Beeinflussung der Reaktionsgeschwindigkeit durch:
a) die Konzentrationsabhängigkeit

b) den Zerteilungsgrad
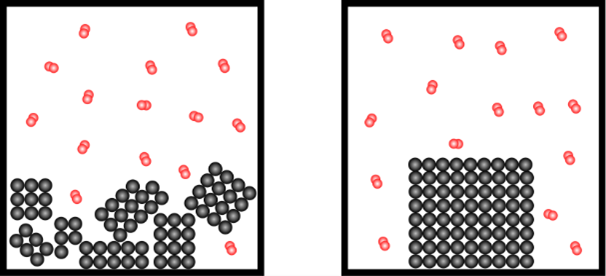
c) die Temperatur
6 Katalysator
Katalysatoren beeinflussen die Reaktionsgeschwindigkeit indem sie die Aktivierungsenergie senken. Dass zwei Teilchen, die zusammenstossen miteinander reagieren wird also dank Katalysatoren wahrscheinlicher.
Katalysatoren können Edukte auch örtlich zusammenbringen, damit diese eher miteinander reagieren. Wir betrachten den Effekt eines Katalysators exemplarisch am Beispiel der Reaktion von Wasserstoff mit Sauerstoff. Diese Reaktion kann durch einen Platinkatalysator beschleunigt werden. Platin ist hier ein heterogener Katalysator.
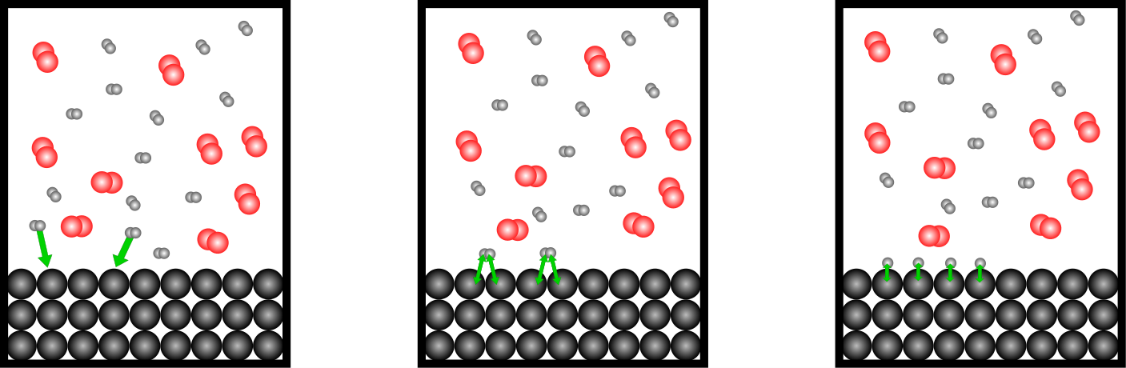
Wasserstoffmoleküle adorbieren auf der Platinoberfläche. Durch die Wechselwirkung mit dem Elektronengas des Metalls Platin, wird die Bindung im Wasserstoffmolekül geschwächt und aufgebrochen. Die Wasserstoffatome sind nun auf der Platinoberfläche adsorbiert.
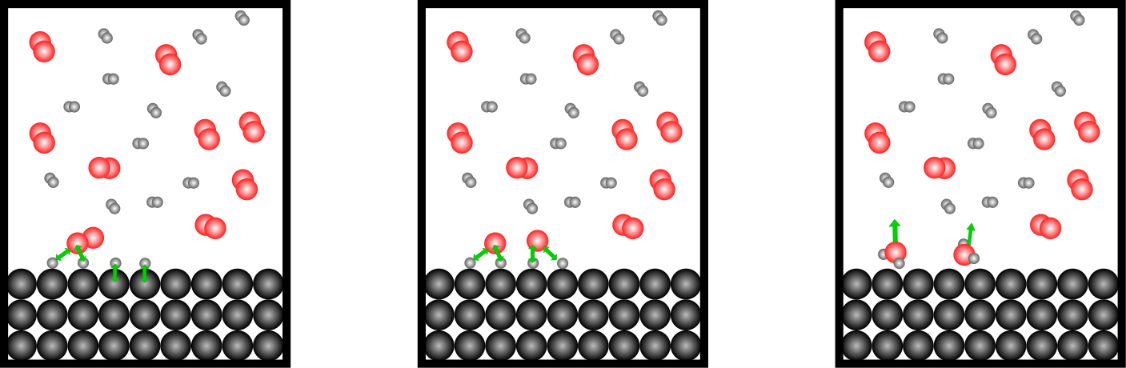
Die Atome reagieren so leichter mit den Sauerstoffmolekülen. Die Bindung des Sauerstoffmoleküls wird dadurch gespalten und beide Sauerstoffatome reagieren mit den Wasserstoffatomen zu Wasser. Durch die Energie die bei der Reaktion frei wird (exotherme Reaktion) erhalten die Wassermoleküle viel Energie.
