Ein Ester bildet sich, wenn ein Alkohol und eine organische oder anorganische Säure (z.B. Carbonsäure) unter Abspaltung von Wasser miteinander reagieren, wobei die Reaktion nur säurekatalysiert ablaufen kann, d. h. es müssen Protonen (H+) vorhanden sein.
Die Reaktion ist eine Gleichgewichts- und Kondensationsreaktion, der Ablauf ist folgender:
Mechanismus der Säurekatalysierten Esterbildung
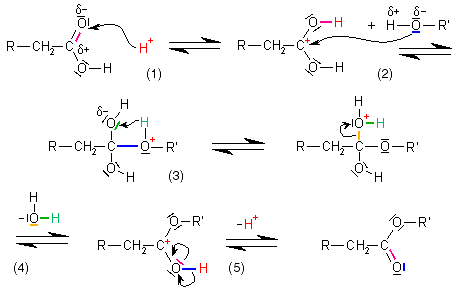
Erläuterung der Teilschritte
Ein Proton (H+) lagert sich an das negativ polarisierte Carbonyl-Sauerstoffatom der Carbonsäure an, die positive Ladung wird auf das Carbonyl-Kohlenstoffatom verschoben, es bildet sich ein Carbokation, das leicht von Nukleophilen angegriffen werden kann.
Ein Alkohol lagert sich an die Carbonsäure an, dabei wird eine kovalente Bindung zwischen dem negativ polarisierten, nukleophilen Sauerstoffatom der Hydroxylgruppe des Alkohols und dem positiv geladenen, elektrophilen Kohlenstoffatom der Carbonsäure gebildet, und die positive Ladung verschiebt sich auf das Sauerstoffatom des Alkohols (was dem stark elektronegativen, elektronenziehendem Sauerstoff nicht gefällt und das Molekül sehr instabil macht).
Das positiv geladene Sauerstoffatom will die positive Ladung loswerden und gibt daher ein Proton (H+) ab, dieses lagert sich an das nächstliegende Sauerstoffatom an, woraufhin dieses die positive Ladung bekommt.
An das nun positiv geladene Sauerstoffatom sind bereits zwei Wasserstoffatome gebunden, für den Sauerstoff ist es also kein Problem, sich das Elektronenpaar zu schnappen, mit dem er an das Kohlenstoffatom gebunden ist und sich so als (ungeladenes) Wassermolekül (H₂O) vom Rest des Moleküls abzuspalten. Die positive Ladung ist nun wieder am Kohlenstoffatom, wo sie zu Beginn schon einmal war.
Das Molekül ist auch mit der positiven Ladung am Kohlenstoff nicht wirklich stabil, daher wird ein Proton (H+) von der noch vorhandenen Hydroxylgruppe abgespalten (die Umkehrreaktion von Schritt 1): Wir haben einen Ester erhalten!
