10Stoffeigenschaften der Alkanole
Siedetemperatur
Vergleicht man die Siedetemperaturen der Alkane mit denen der Alkanole, so fällt auf, dass die Siedetemperaturen der Alkanole mit vergleichbarer Molarer Masse deutlich höher liegen als bei den Alkanen (siehe Abbildung 11).
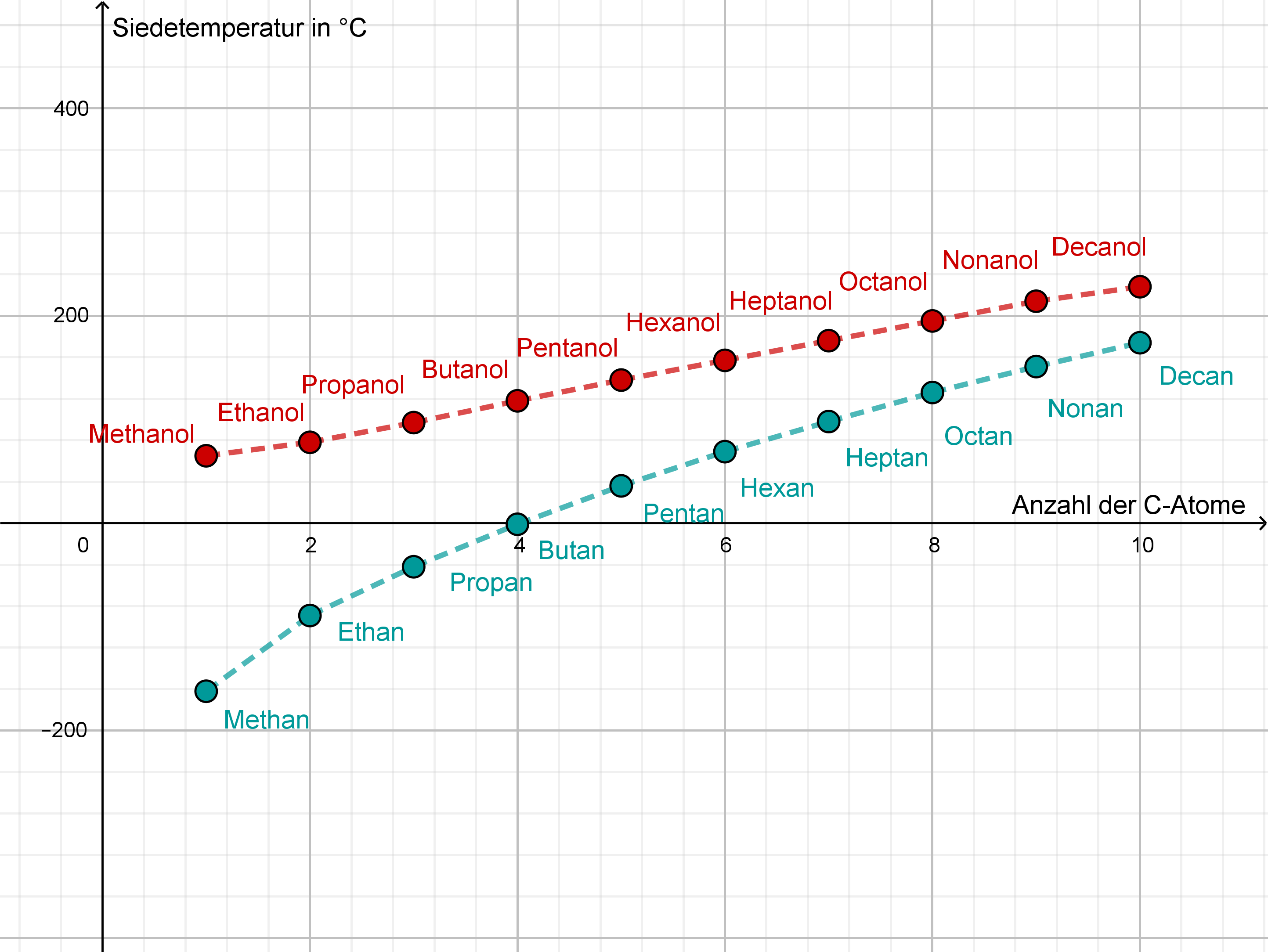
Abbildung 11: Siedetemperaturen der Alkane und Alkanole (erstellt mit GeoGebra)
Warum ist das so?
Um diese Frage zu beantworten muss die Hydroxy-Gruppe der Alkanole genau unter die Lupe genommen werden:Dadurch dass das Sauerstoffatom eine Elektronegativität von 3,5 und das Wasserstoffatom eine von 2,1 hat, ist die Elektronegativitätsdifferenz vergleichsweise sehr hoch (ΔEN=1,4). Somit zieht das Sauerstoffatom aufgrund seiner hohen Elektronegativität das bindende Elektronenpaar zu sich heran, sodass es zu einer Ladungsverschiebung kommt. Durch diese Ladungsverschiebung ist die Hydroxygruppe stark polar (polare Bindung), da das Sauerstoffatom eine negative Teilladung und das Wasserstoffatom dementsprechend eine positive Teilladung erhält (siehe Abbildung 12).
Der Alkylrest im Molekül hingegen ist unpolar, da die Elektronegativitätsdifferenz des Kohlenstoffatoms und Wasserstoffatoms - aufgrund der sehr ähnlichen Elektronegativität - fast null ist.
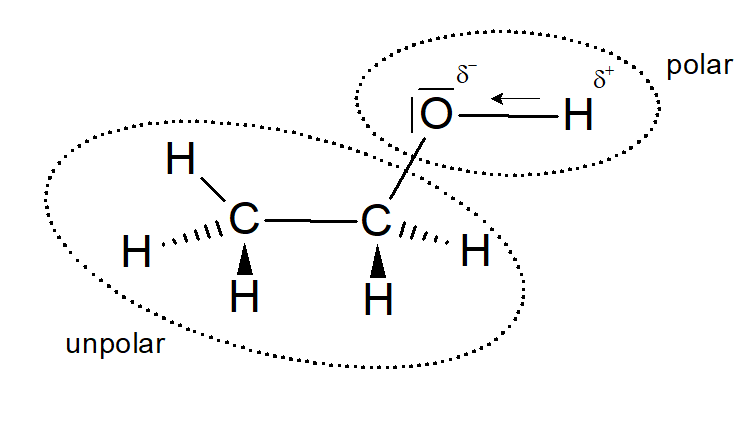
Abbildung 12: Polarität des Ethanols (erstellt mit ChemSketch)
Dadurch dass sich die negativen Sauerstoffatom mit den positiven Wasserstoffatomen anziehen, kommt es an den OH-Gruppen der Alkanole zu starken zwischenmolekularen Kräften - den Wasserstoffbrücken (siehe Abbildung 13).
Somit herrschen zwischen den Alkanol-Molekülen nicht nur die Van-Der-Waals Kräfte (wie es bei den Alkanol-Molekülen der Fall ist), sondern es liegen zusätzlich noch Wasserstoffbrückenbindungen vor. Das heißt, dass beim Sieden der Alkanole diese zusätzlichen zwischenmolekularen Kräften überwunden werden müssen, was die vergleichsweise hohe Siedetemperatur erklärt (vgl. Abb. 13).
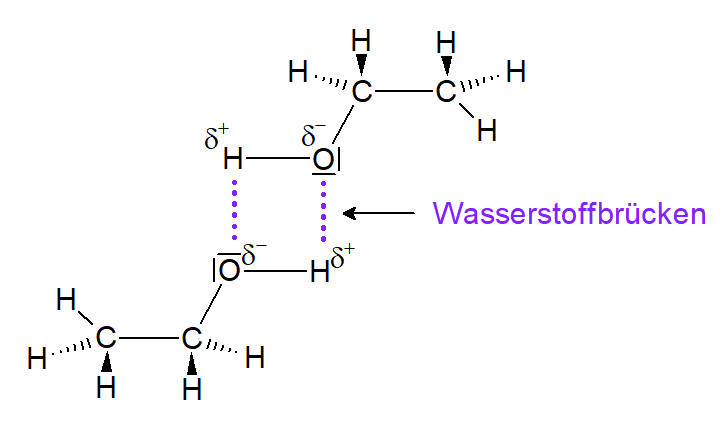
Abbildung 13: Wasserstoffbrücken zwischen Ethanolmolekülen (erstellt mit ChemSketch)
Löslichkeit
Name | Löslichkeit in Wasser (25 °C) | Löslichkeit in Benzin |
|---|---|---|
Methanol | beliebig löslich | unlöslich |
Ethanol | beliebig löslich | löslich |
Propan-1-ol | beliebig löslich | löslich |
Butan-1-ol | löslich | |
Pentan-1-ol | löslich | |
Hexan-1-ol | löslich | |
Hexadecan-1-ol | unlöslich | löslich |
Tabelle 2: Löslichkeit der Alkanole in Wasser und Benzin
(Alkane sind in Benzin alle löslich, in Wasser jedoch nicht löslich.)
Vergleicht man die Löslichkeit der Alkohole mit denen der Alkane, so fallenzwei Sachverhalte auf:
Mit Zunehmender Länge der Kohlenstoffkette der Alkoholmolekülenimmt die Löslichkeit der Alkohole in Wasser immer weiter ab.
Im Gegensatz zu den Alkanen sind (kurzkettige) Alkohole in Wasserlöslich.
Woran liegt das?
Schauen wir uns einmal den Aufbau eines Alkoholmolekülsnoch einmal genauer am Beispiel des Ethanols und des Decanols an:
Ein Alkoholmolekül besitzt immer mindestens eine Hydroxy-Gruppe(-OH-Gruppe)Diese zeichnet sich durch eine hohe Elektronegativitätsdifferenz der beiden Atome von 1,4 aus, was bedeutet, dass diese funktionelle Gruppe polar ist. Wir wissen, dass Wassermoleküle ebenfalls polar sind und schlussfolgern aus dem Merksatz "Ähnliches löst sich in Ähnlichem", dass sich Alkohole in Wasser und anderen polaren Stoffen lösen lassen.
Warum aber gilt das nicht für längerkettige Alkohole wie etwa Decanol?
Im Vergleich zu Ethanol besitzt Decanol eine deutlich längere Kohlenstoffkette. Die C-H-Bindungen dieser weisen eine geringe Elektronegativitätsdifferenz der Atome von nur 0,4 auf, was bedeutet dass dieses Molekülteil unpolar ist. Er wird allgemein als unpolarer Rest bezeichnet. Je länger jetzt also dieser unpolare Rest ist, desto mehr bestimmt er die physikalischen Eigenschaften des Moleküls und senkt somit dessen Polarität, was die Abnahme der Wasserlöslichkeit mit zunehmender Länge der Kohlenstoffkette bei Alkoholen erklärt.
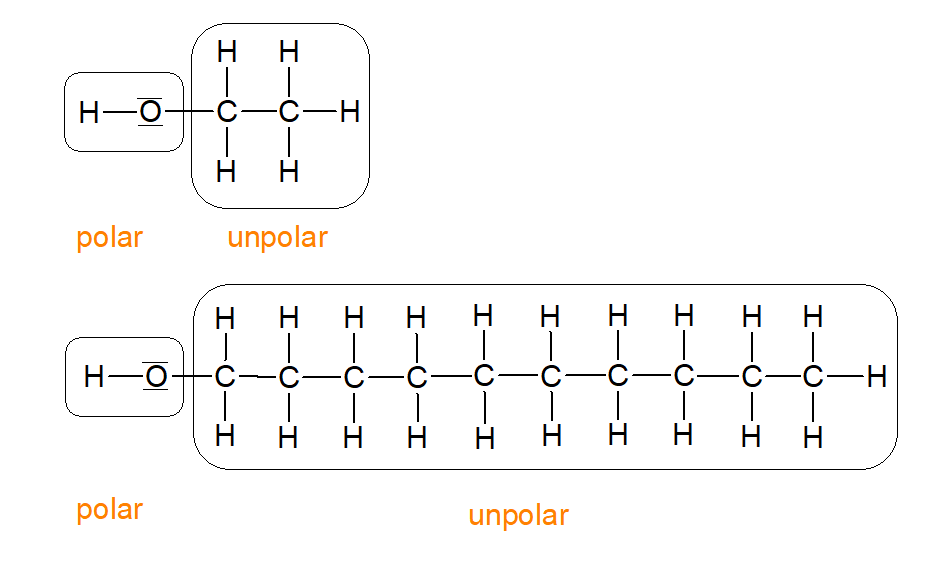
Abbildung 14: Vergleich von Ethanol und Decanol (erstellt mit ChemSketch)
