7Vertiefung: Oxidationszahlen
Die Oxidationszahl lässt sich nicht immer mit den eben genannten Regeln bestimmen. In diesem Fall kann sie aber mithilfe der Elektronegativitäten und Gruppen der Elemente bestimmt werden.
Diese können einfach in einem Periodensystem nachgeschaut werden. Dabei betrachten wir hier hauptsächlich die Hauptgruppen (Gruppe 1, 2, 13, 14, 15, 16, 17 und 18).
Bestimmen wir zunächst die Oxidationszahlen aller Elemente im Kaliumchlorat (KClO3). Dazu betrachten wir zunächst die jeweiligen Elektronegativitäten und ordnen dann in jeder Bindung den Elementen mit höherer Elektronegativität eine negative Teilladung (-) und denen mit niedrigerer Elektronegativität eine positive Teilladung (+).
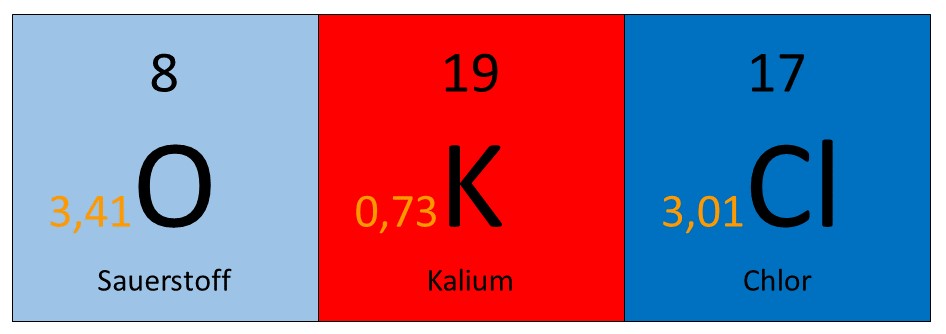
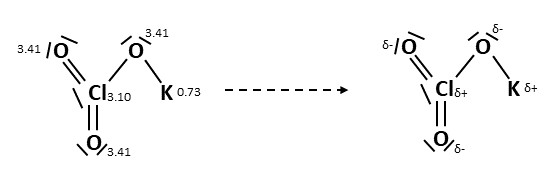
Betrachten wir beispielsweise dieses Molekül, würde man sich zuerst eine beliebige Bindung heraussuchen. Zum Beispiel die Verbindung zwischen und , da kann man sehen, dass die Elektronegativität vom Sauerstoff deutlich höher ist, also erhält der Sauerstoff die negative Teilladung und das Kalium die positive.
So kannst du nach und nach jede Bindung einzeln betrachten und die Teilladungen zu sortieren.
Bedenke, dass es sich bei jeder Verbindungslinie zwischen zwei Elementen um zwei Bindungselektronen handelt.
Außerdem handelt es sich bei den Linien neben den Atomen um zwei freie Elektronen.
Elemente mit negativer Teilladung ziehen nun alle Elektronen aus den Bindungen zu sich. Das lässt sich wie folgt darstellen. Alle rot-markierten Bindungen und freien Elektronenpaare gehören zu den elektronegativeren Sauerstoffatomen.
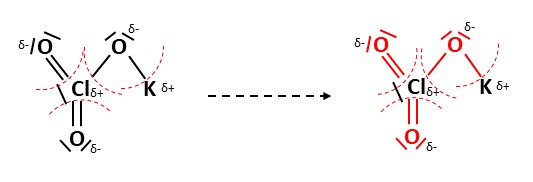
Anhand der Gruppe, in welcher sich das Element befindet, lässt sich die Wertigkeit ablesen. Die Wertigkeit beschreibt die Anzahl der Elektronen, die ein Element im Normalzustand besitzt. Elemente der 1. Hauptgruppe besitzen jeweils die Wertigkeit eins, der 2. Hauptgruppe zwei, der 3. drei und so weiter.
Nun zählen wir einfach ab, wie viele Elektronen zu jedem Element gehören und ziehen das von der Anzahl der Elektronen im Normalzustand ab. So erhalten wir die Oxidationszahl der jeweiligen Elemente.
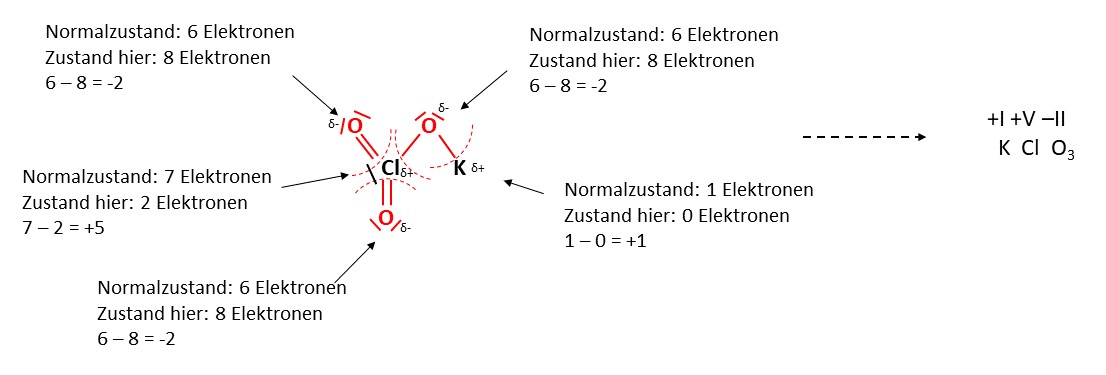
Auf diese Art und Weise können alle Oxidationszahlen bestimmt werden. Für die Verwendung werden Oxidationszahlen als Römische Zahlen über das jeweilige Element geschrieben.
Übrigens! Wenn zwei Elemente einer Bindung dieselbe Elektronegativität haben, teilen sie die Bindungselektronen 1:1 auf.
