Isomere sind chemische Verbindungen mit der gleichen Summenformel aber unterschiedlicher chemischer Struktur. Die strukturellen Unterschiede können zu unterschiedlichen chemischen, physikalischen und biologischen Eigenschaften führen.
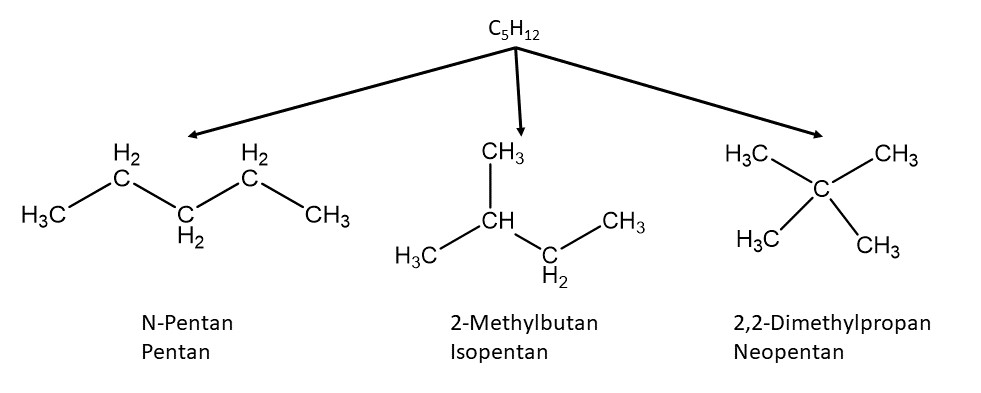
Der Name Isomer leitet sich übrigens aus dem griechischen ab. Isos bedeutet gleich und meros bedeutet Teil.
Isomere sind also aus gleichen Teilen.
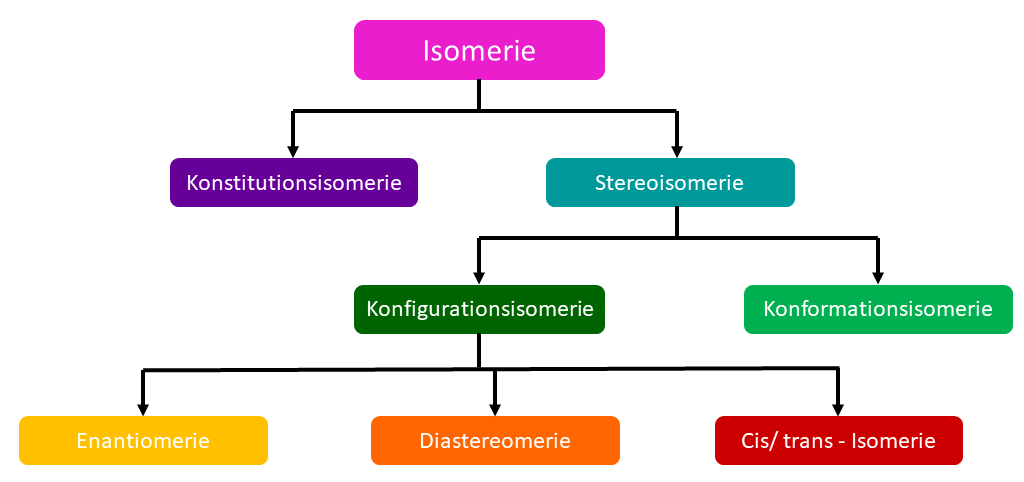
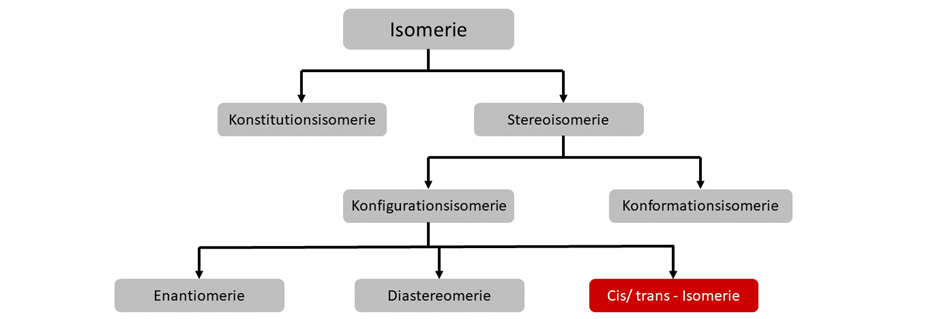
Im Allgemeinen unterscheidet man in verschiedene Isomerie-Formen. Diese sind hier abgebildet.
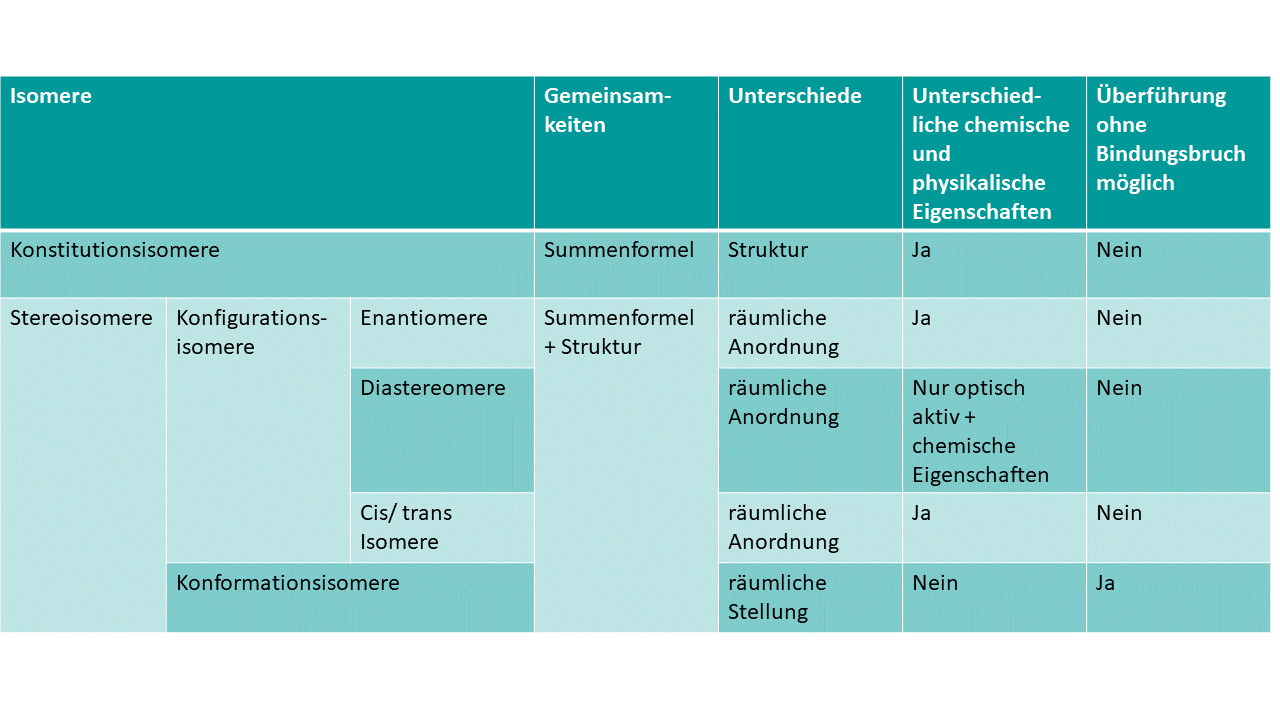
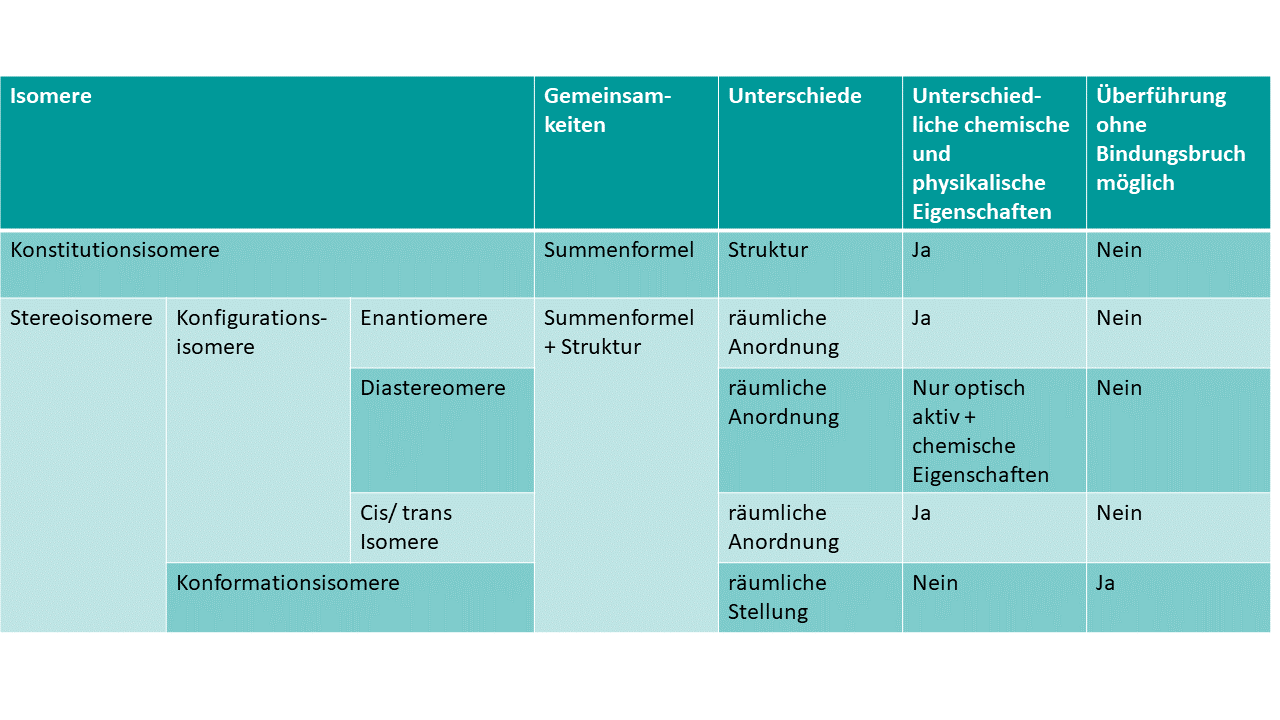
Eine kurze Zusammenfassung der Eigenschaften findest du in dieser Tabelle, wenn du gerne genauere Informationen hättest findet du sie weiter unten im Artikel.
Konstitutionsisomerie
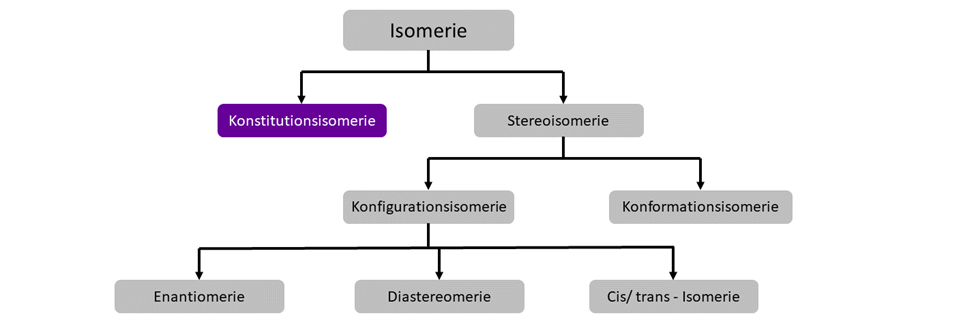
Konstitutionsisomere sind chemische Verbindungen mit derselben Summenformel, aber unterschiedlich verknüpften Atomen. Um ein Konstitutionsisomer einer Verbindung zu schaffen, muss immer mindestens eine Bindung gebrochen und neu verknüpft werden. Konstitutionsisomere unterscheiden sich also in ihrer Struktur.
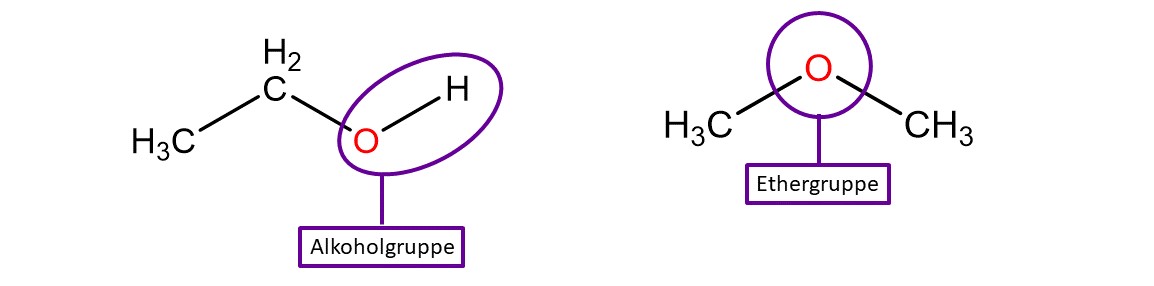
Ein Beispiel für Konstitutionsisomere ist . Diese Verbindung kann entweder mit Alkoholgruppe vorliegen, dann nennt man sie Ethanol (Trinkalkohol) oder mit Ethergruppe. Dann nennt man sie Dimethylether (Treibmittel im Haarspray).
Konstitutionsisomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften. So können Verbindungen mit der gleichen Summenformel bei Raumtemperatur in verschiedenen Aggregatzuständen vorkommen. Außerdem ist eine Verbindung für Menschen nur leicht giftig (Ethanol), die andere kann tödlich sein (Dimethylether).
Stereoisomerie
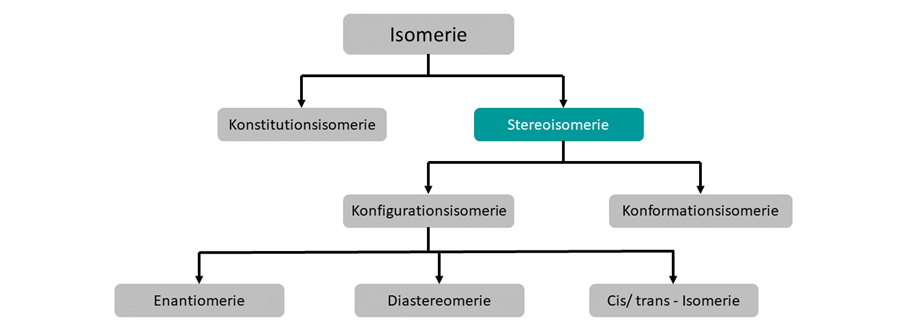
Stereoisomerie beschreibt Verbindungen mit derselben Summenformel, derselben Struktur (Konstitution), aber einer abweichenden räumlichen Anordnung der Atome. Stereoisomere können weiter unterschieden werden in Konfigurations- und Konformationsisomere.
Konformationsisomerie
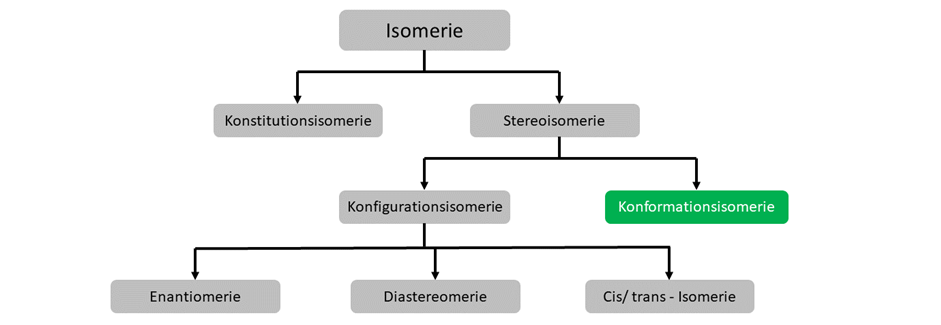
Konformationsisomere unterscheiden sich nur in der räumlichen Stellung, eine Verbindung hat also dieselbe Summenformel, dieselbe Struktur und unterscheidet sich nur dadurch das eine Einfachbindung rotiert wurde.
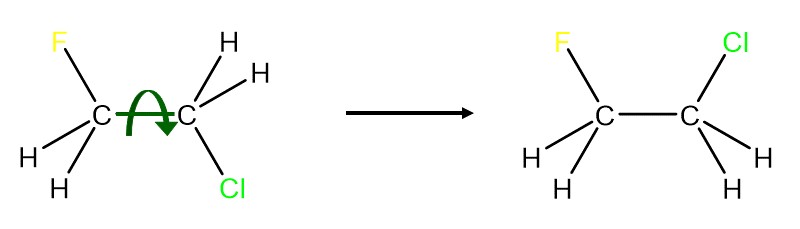
Die Überführung von einem Konformationsisomer in ein anderes ist durch eine einfache Drehung und ohne Bindungsbrüche möglich. Konformationsisomere lassen sich meist nicht isolieren, da sie sich problemlos ineinander umwandeln können.
Konformationsisomere unterscheiden sich nicht in ihren chemischen und physikalischen Eigenschaften.
Konfigurationsisomerie
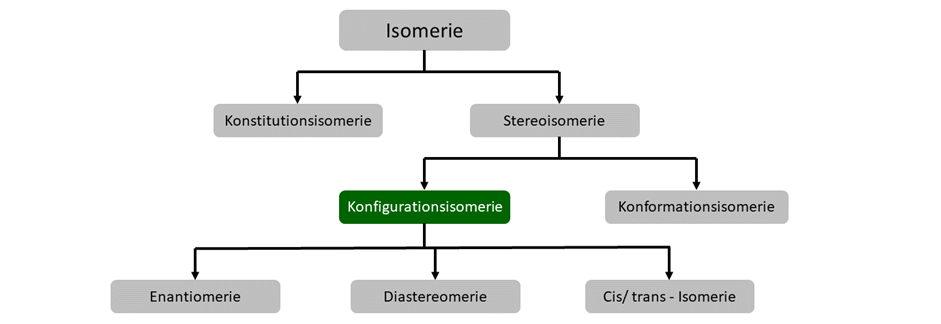
Konfigurationsisomerie ist etwas komplexer. Hier besitzen die Verbindungen dieselbe Summenformel, dieselbe Struktur, aber sie unterscheiden sich in ihrer räumlichen Anordnung. Im Gegensatz zu Konformationsisomeren lassen sich die Isomere aber nur durch einen Bindungsbruch ineinander überführen.
Konfigurationsisomere werden weiter unterscheiden in Enantiomere und Diastereomere. EIn Spezialfall ist außerdem noch die Cis-/Trans-Isomerie.
Enantiomerie
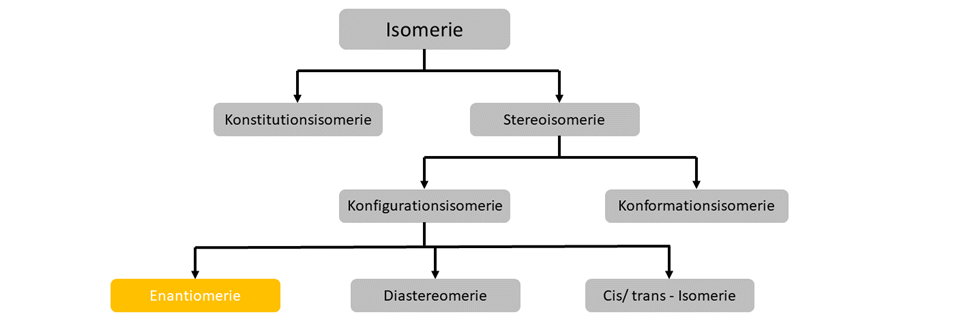
Enantiomere sind Konfigurationsisomere, welche sich wie Bild und Spiegelbild zueinander verhalten, aber keine Symmetriebene innerhalb des Moleküls aufweisen. Diese Eigenschaft bezeichnet man auch als Chiralität. Sie beschreibt Stoffe mit derselben Summenformel und Struktur, welche gespiegelt sind, aber nicht deckungsgleich.
Ein gutes Beispiel sind unsere Hände: Halte beide Hände mit den Handflächen nach unten vor dich. Dann siehst du, dass sie genau gleich aussehen, aber spiegelverkehrt zueinander sind. Versuchst du nun beide Hände übereinander zulegen, kannst du sie nicht zur Deckung bringen.
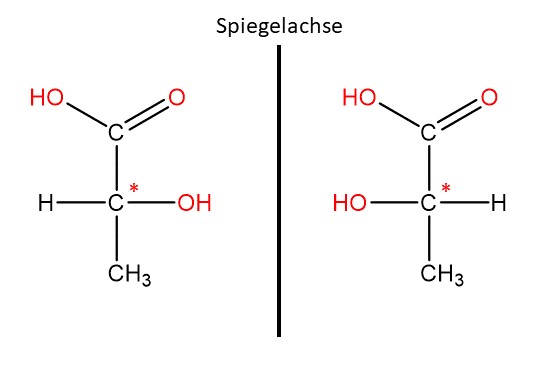
Der rote Stern (*) am Kohlenstoffatom markiert dieses als "chirales Zentrum". Ein Atom ist dann chiral wenn es vier verschiedene Substituenten hat. So hat dieses Kohlenstoffatom als Substituent eine Carbonsäuregruppe (), eine Alkoholgruppe () eine Methylgruppe () und ein Wasserstoffatom ().
Wenn du die eine Struktur in die andere überführen willst, muss zunächst eine Bindung gebrochen werden.
Chirale Moleküle haben besondere Eigenschaften. Die hier abgebildete Milchsäure kann Lichtwellen drehen. Die erste Struktur dreht Wellen nach rechts (rechtsdrehende Milchsäure) während die zweite Struktur Lichtwellen nach links dreht (linksdrehende Milchsäure). Diese Eigenschaft bezeichnet man als optische Aktivität.
Enantiomere unterscheiden sich in ihrem Drehwert, sowie ihren chemischen und physiologischen Eigenschaften.
Das berühmteste Beispiel dafür ist der Contergan-Skandal. Dabei stellte sich heraus, dass ein Enantiomere eines medizinischen Wirkstoffes als Schlafmittel fungiert. Das andere Enantiomer führte jedoch zu schweren Missbildungen in Kindern.
Diastereomie
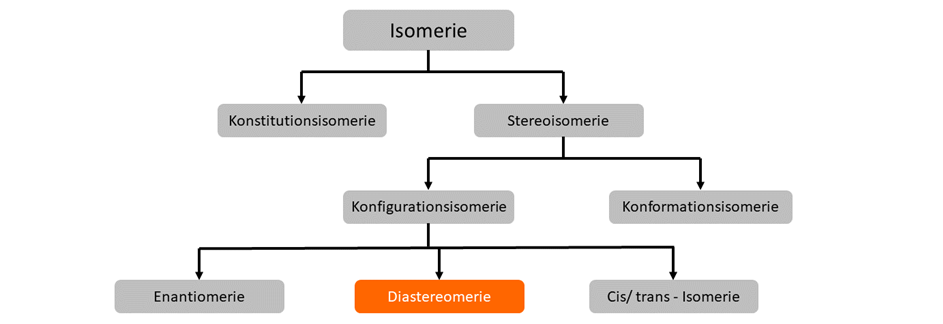
Bei Diastereomeren handelt es sich um alle Konfigurationsisomere, die keine Enantiomere sind. Diastereomere verhalten sich nicht wie Bild und Spiegelbild und besitzen mehr als ein chirales Zentrum. Die meisten Diastereomere sind chiral, allerdings kann es durch Symetrieebenen im Molekül zu Achiralität (nicht chiral) kommen.
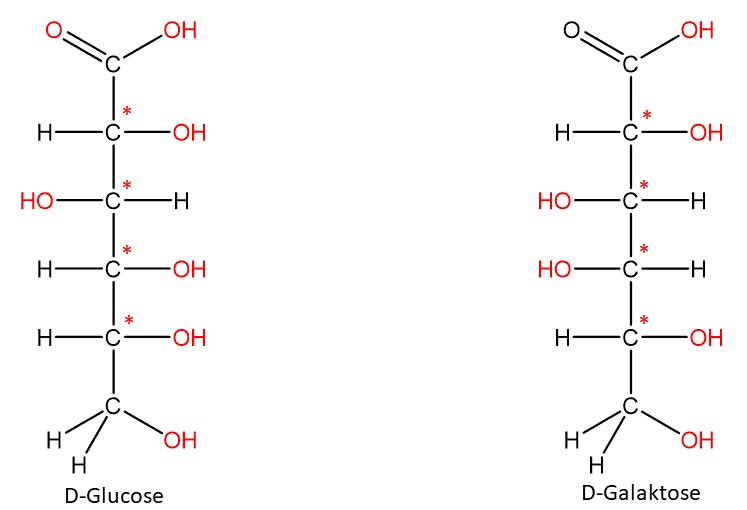
Um Diastereomere ineinander umzuwandeln, muss mindestens eine Bindung gebrochen werden. Diastereomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften.
Bei der Glucose handelt es sich beispielsweise um den handelsüblichen Traubenzucker (Dextrose). Bei Galactose handelt es sich um einen deutlich weniger süßen Zucker, welcher unter anderem in Muttermilch vorkommt.
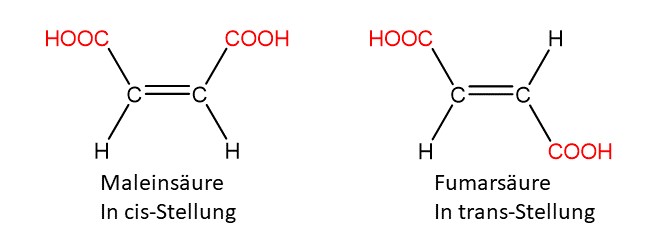
Cis/trans-Isomerie
Die cis/trans-Isomerie ist eine spezielle Form der Konfigurationsisomerie. Hier unterscheiden sich Isomere nur in der Stellung zweier Substituenten zueinander. Stehen sie auf der gleichen Seite, nennt man das cis- (oder Z-) Anordnung. Stehen sie sich gegenüber bezeichnet man das an trans- (oder E-) Anordnung.
Zusammenfassung
Laden
Quellen
- https://de.wikipedia.org/wiki/Isomerie
- Wollrab, Adalbert (1999) Organische Chemie- Eine Einführung für Lehramts- und Nebenfachstudenten.
