Als Aggregatzustände bezeichnet man die drei Zustandsformen von Stoffen, fest, flüssig und gasförmig. Die drei Zustandsformen unterscheiden sich in der Bewegung und der Anordnung der kleinsten Teilchen, d.h. der Atome und Moleküle. Wasser kann als Eis (fest), in Tropfenform (flüssig) und als Dampf (gasförmig) erscheinen.
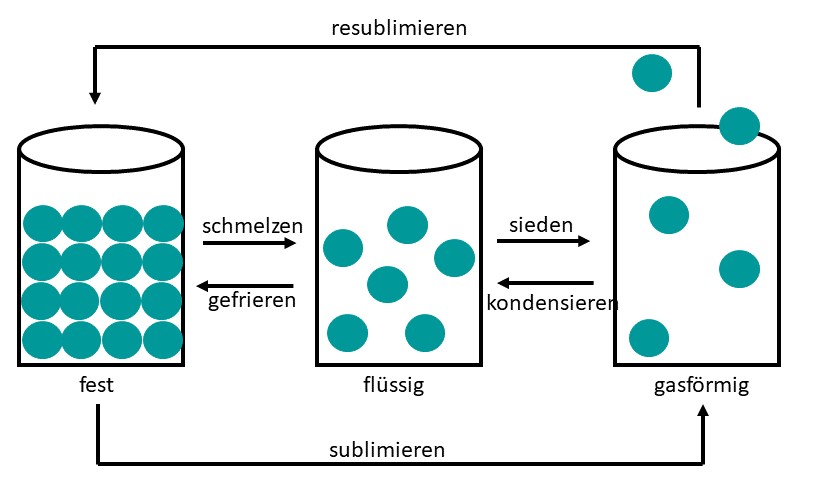
Schmelzen - erstarren, verdampfen - kondensieren und sublimieren - resublimieren beschreiben die Übergänge zwischen den Aggregatzuständen.
In unserem Alltag können wir Wasser je nach Temperatur und Druck in den drei Aggregatzuständen fest, flüssig oder gasförmig beobachten und sprechen dann von Eis als gefrorenem Wasser, dem flüssigen Wasser selbst und dem gasförmigen ‚Dampf‘.

Gasförmiges Wasser ist unsichtbar. Nebel und Wolken werden erst dadurch sichtbar, dass sie ein Gemisch aus Gasen und winzigen (flüssigen) Wassertropfen sind, die sich als Ergebnis der Kondensation bilden. Wolken können zusätzlich noch Eiskristalle enthalten. Weitere Beispiele sind das Sieden von Wasser im Kochtopf oder eine Tasse mit heißem Tee oder Kaffee. Das Wasser verdunstet und - aufgrund der Raumtemperatur - kondensiert das Wasser wieder. Dabei beobachten wir den weißen Wasserdampf.
Als Abkürzungen werden die jeweiligen Anfangsbuchstaben f (fest), fl (flüssig) und g (gasförmig) verwendet. Es ist auch üblich, die ersten Buchstaben der englischen Bezeichnungen zu verwenden: g (gaseous), l (liquid) und s (solid).
Zustände im Teilchenmodell
Die drei Zustandsformen fest, flüssig und gasförmig lassen sich durch die Ordnung der kleinsten Teilchen erklären. Die Veränderung der Temperatur führt zu einer Änderung der Bewegungsenergie der Teilchen. Bei zunehmender Temperatur wird ihre Bewegung stärker, bei abnehmender Temperatur schwächer.
fest
Die Teilchen nehmen feste Plätze ein und liegen sehr dicht aneinander. Sie bewegen sich geringfügig.

flüssig
Die Teilchen nehmen keine festen Plätze ein, sie sind gegeneinander beweglich.

gasförmig
Die Teilchen sind frei beweglich, ihre Abstände sind sehr groß.

Plasma - der vierte Aggregatzustand
Häufig wird auch von einem vierten Aggregatzustand gesprochen, dem Plasma. Man bezeichnet damit einen Stoff, dessen Bestandteile teilweise oder vollständig in Ionen und Elektronen „aufgeteilt“ sind.
Plasma lässt sich durch starkes Erhitzen von gasförmigen Stoffen oder mithilfe von elektrischen Feldern erzeugen.
Die Eigenschaften von Plasma lassen sich nicht genau festlegen, da sie in Abhängigkeit von Bedingungen der Umgebung (Temperatur, Feldstärken) sehr unterschiedlich sein können.
Plasma kann man zum Beispiel bei folgenden Naturphänomenen beobachten:

Technisch gibt es einige Anwendungen, in denen Plasma erzeugt wird. Die bekannteste ist sicher die Gasentladungslampe, wie bei Leuchtstoffröhren oder Energiesparlampen. Dabei wird ein gasförmiger Stoff (Quecksilberdampf, Neon, Argon, o.ä.) durch elektrische Spannung ionisiert.

Aggregatzustände des Wassers
Im festen Zustand bildet Wasser Eiskristalle. Die einzelnen Wasser-Moleküle sind dabei geometrisch angeordnet und stark aneinander gebunden. Erwärmt man festes Eis, dann lösen sich einige der Bindungen, es wird flüssig.
Im flüssigen Zustand gibt es nur mäßig starke Anziehungskräfte zwischen den Wasser-Molekülen. Deswegen kann Wasser im flüssigen Zustand sich an jedes Gefäß anpassen. Betrachtet man einen Wassertropfen, kann man diese Anziehungskräfte gut sehen, da sie ein auseinander gleiten der Moleküle verhindern. Erwärmt man flüssiges Wasser weiter, lösen sich auch diese Bindungen, es wird gasförmig.
Im gasförmigen Zustand gibt es nahezu keine Bindungen zwischen den Wassermolekülen. Sie können sich also frei bewegen, es ist keine Form mehr erkennbar, wie bei den Eiskristallen oder den Wassertropfen. Kühlt man gasförmiges Wasser ab, bilden sich wieder mehr Bindungen aus und es entstehen Wassertropfen.

Änderung des Aggregatzustands
Schmelzen: Der Übergang von fest zu flüssig
Im festen Zustand liegen die kleinen Teilchen an festen Plätzen vor und bewegen sich nur wenig. Bei zunehmender Temperatur wird die Teilchenbewegung stärker. Schließlich wird das Schwingen der Teilchen in ihren Plätzen so stark, dass sie sich aus diesen lösen. Beim Erreichen der Schmelztemperatur lösen sich einige der Bindungen, der Stoff schmilzt und wird flüssig.
Sieden, der Übergang von flüssig zu gasförmig
Im flüssigen Zustand gibt es noch einige Bindungen. Flüssige Stoffe können sich an alle Gefäße anpassen, aber es gibt trotzdem noch einigen Zusammenhalt. Bei zunehmender Temperatur wird die Teilchenbewegung stärker. Schließlich wird die Bewegung der Teilchen so stark, dass sich die Bindungen vollständig voneinander lösen. Der Stoff siedet, er verdampft und wird gasförmig.
Sublimieren, der Übergang von fest zu gasförmig
Im festen Zustand bestehen sehr viele Bindungen zwischen den Teilchen. Jedes Teilchen ist dabei an einem bestimmten Platz. Beim Erhitzen können diese Teilchen so stark zu schwingen beginnen, dass sie den Teilchenverband direkt verlassen. Der Stoff sublimiert. Er geht direkt vom festen in den gasförmigen Zustand über, ohne zwischendurch flüssig zu werden.
Resublimieren, der Übergang von gasförmig zu fest
Im gasförmigen Zustand bewegen sich die Teilchen mit großer Geschwindigkeit und es gibt kaum Bindungen zwischen den Teilchen. Zwischen ihnen befinden sich große Abstände. Sinkt die Temperatur, wird die Teilchenbewegung geringer. Hierbei nehmen die kleinen Teilchen feste Plätze ein und schwingen nur noch um diese Stellen. Der Stoff ist fest geworden. Man sagt, er ist resublimiert.
Kondensieren, der Übergang von gasförmig zu flüssig
Mit großer Geschwindigkeit bewegen sich die Teilchen im gasförmigen Zustand, zwischen ihnen befinden sich große Abstände. Bei abnehmender Temperatur verringert sich die Teilchenbewegung. Schließlich wird die Bewegung der Teilchen so klein, dass sie sich aufgrund der Kräfte, die zwischen ihnen wirken, dicht beieinander befinden. Der Stoff kondensiert. Der Stoff wird flüssig.
Gefrieren, der Übergang von flüssig zu fest
Im flüssigen Zustand gibt es einige Bindungen zwischen den Teilchen. Bei abnehmender Temperatur wird die Teilchenbewegung geringer. Schließlich ist die Bewegung so gering und es bilden sich so viele Bindungen aus, dass die Teilchen einen festen Platz einnehmen. Der Stoff erstarrt, er wird fest.