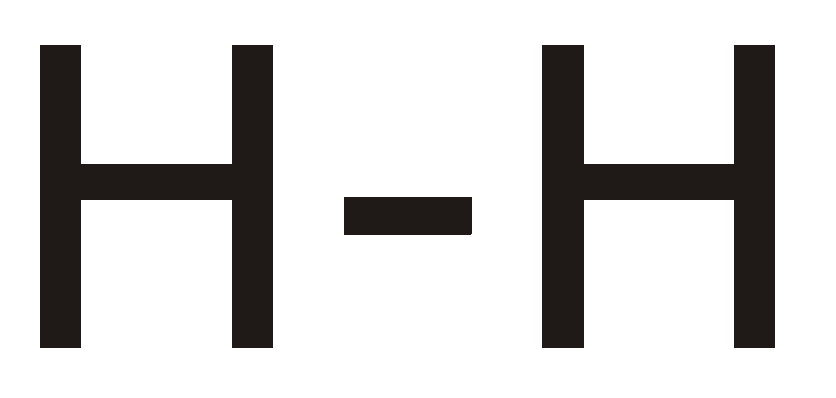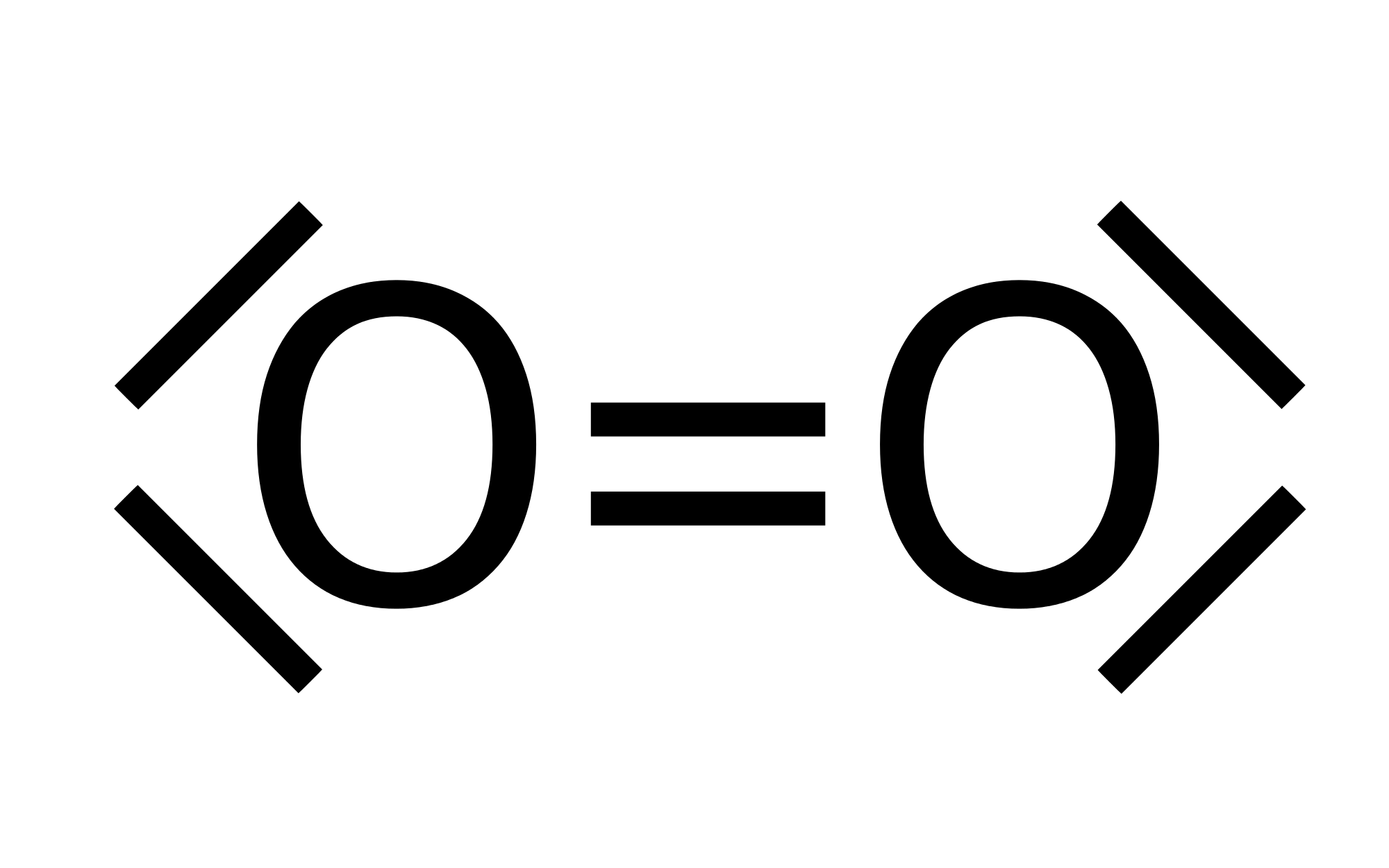In diesem Artikel findest du die Erklärungen zu den verschiedenen Intermolekularen Kräften.
Gliederung:
Inter- und intramolekulare Kräfte
Was ist Elektronegativität? - unpolare und polare Atombindungen
Was ist ein Dipol? - Moleküle mit asymmetrisch verteilten Partialladungen
Van-der-Waals-Kräfte
Wasserstoffbrückenbindungen
Dipol-Dipol-Wechselwirkungen
Ion-Dipol-Wechselwirkungen
Überblick mit Alltagsbezug
1. Inter- und intramolekulare Kräfte
In der Chemie unterscheidet man zwei verschiedene Arten von Kräften: Die intermolekularen und die intramolekularen Kräfte.
Intermolekulare Kräfte bzw. chemische Bindungen im engeren Sinne herrschen zwischen den verschiedenen Molekülen untereinander. Es gibt die Van-der-Waals-Krafte, die Dipol-Dipol-Wechselwirkungen, die Wasserstoffbrücken un die Dipol-Ionen-Wechselwirkungen.
Intramolekulare Kräfte herrschen innerhalb einzelner Teilchen. Hierbei gibt es verschiedene Möglichkeiten der Bindung:
1.1 Nichtmetall/Nichtmetall: Atombindung, Elektronenpaarbildung
1.2 Metall/Metall: Metallbindungen
1.3 Metall/Nichtmetall: Ionenbindung, Salzbindung
Diese Art der molekularen Kräfte, die auch als zwischenmolekulare Kräfte bezeichnet werden, soll nun im Folgenden erklärt werden anhand von einigen Erklärungstexten.
2. Was ist Elektronegativität? - polare und unpolare Atombindungen
Das Elektronegativität ist ein Maß, das angibt, wie stark ein Atom in einer Atombindung die Bindungselektronen anzieht. Von links nach rechts im Periodensystem der Elemente nimmt die Elektronegativität der Atomsorten zu, weil der Atomradius abnimmt und die Valenzelektronen deshalb stärker vom eigenen Kern angezogen werden. Von oben nach unten dagegen in der Periodenskala nimmt die Elektronegativität ab, da der Atomradius immer größer wird und der eigene Atomkern die Valenzelektronen nicht so stark anziehen kann.
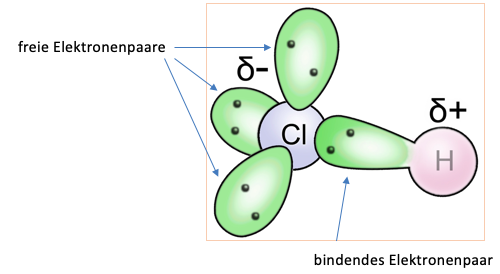
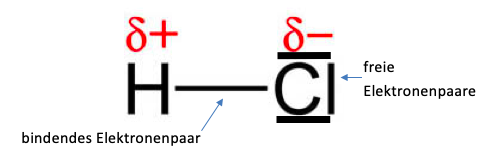
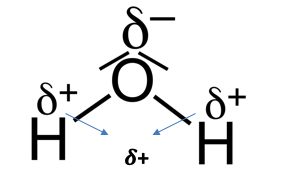
Wie bei dem Beispiel des Hydrogenchlorid-Moleküls zu sehen ist, besitzen die Atome eine unterschiedliche Elektronegativität. Sie liegt für das Wasseratom bei 2,2 und für das Chloratom bei 3,16. Daraus resultiert, dass die Elektronen stärker vom Chloratom angezogen werden und somit eine Ladungsverschiebung entsteht, denn wie im unteren Bild zu sehen ist, wird das Valenzelektron des Wasserstoffatoms stark vom Chloratom angezogen. Die Partialladung des Wasserstoffatoms ist somit positiv und die des Chloratoms negativ. Dies wird ebenfalls mit den folgenden Zeichen verdeutlicht.
Abbildung 1: Ein Chlorwasserstoffmolekül mit eingezeichneten Elektronenpaaren sowie Partialladungen
3. Was ist ein Dipol? - Moleküle mit asymmetrisch verteilten Partialladungen
Bei einem Dipol sind die Elektronen unsymmetrisch verteilt, weil die Atome eine unterschiedliche Elektronegativität haben. Die Schwerpunkte der positiven und negativen Ladungen fallen also nicht zusammen. Nicht nur polare Atombindungen, sondern auch freie Elektronen können zu einer Polarität beitragen.
Wie findet man heraus, ob ein Molekül ein Dipol darstellen?
Den räumlichen Bau des Moleküls bestimmen nach dem Elektronenpaarbildungsmodell (EPA)
Mithilfe der Elektronegativität die Partialladungen der Atome bestimmen und diese mit den folgenden Zeichen markieren
Wenn die partiellen Ladungsschwerpunkte zusammenfallen, liegt ein Dipol vor wie beispielsweise in Abbildung 2 zu sehen.
Die folgenden drei Beispiele stellen zwei Moleküle, Dipole und ein unpolares Molekül dar:
Wasser ist wiederum ein Dipol, da die Differenz der Elektronegativität über 0,5 liegt (H=2,2/O=3,5) und die Ladungsschwerpunkte aufgrund des Aufbaus des Atoms nicht zusammenfallen.
4. Van-der-Waals-Kräfte
In dem Molekülorbital (= Aufenthaltsräume der Elektronen) sind die Elektronen auf bestimmten Aufenthaltslinien frei beweglich. Die positive Kernladung ist dagegen stationär. Dies führt zu einer sich ständig ändernden Verteilung negativer Partialladungen im Molekül.
Dabei kann es passieren, dass sich die Elektronen zufällig vermehrt in einem bestimmten Bereich aufhalten und es somit zu einer temporären (= kurzfristigen) Trennung der Schwerpunkte der positiven und der negativen Ladungen kommt. Es entstehen eine positive und eine negative Partialladung (lat. pars = "Teil", daher auch Teilladung). Deshalb werden sie auch temporäre Dipole gennant. Dadurch gelten die Van-der-Waals-Kräfte auch als Sonderfall der Dipol-Dipol-Wechselwirkungen.
Durch eine kurzzeitig auftretende, geringfügige Verschiebung der Elektronendichten Atomhüllen werden die Moleküle so zu schwachen Dipolen, die einander anziehen. Die sogenannten Van-der-Waals-Kräfte sind also schwache elektrostatische Anziehungskräfte zwischen schwachen, temporären und induzierten Dipolen.
In den folgenden Abbildungen sind...
5. Wasserstoffbrückenbindungen (besonders starke Dipol-Dipol-WW)
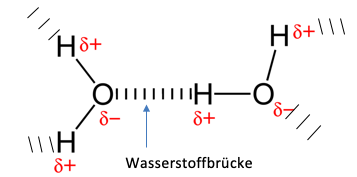
Wasserstofbrücken sind elektrostatische Anziehungskräfte zwischen einem stark positiv polarisierten Wasserstoffatom und einem stark negativ polarisierten Sauerstoffatom, die auch bei Stickstoff, Fluor und in manchen Fällen Chlor auftreten können. Es sind also besonders starke Dipol-Dipol-Wechselwirkungen.
Dieses Zusammenspiel von polarisierten Atomen ist in der folgenden Abbildung wiederzufinden. Hier wird die Wechselwirkung zwischen dem Sauerstoffatom und dem Wasserstoffatom mithilfe vom Eintragen der Partialladungen und dem Markieren der gegenseitigen Anziehungen verdeutlicht.
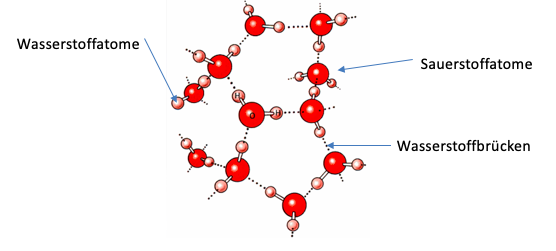
Dieses System mit der Bildung von Wasserstoffbrücken zwischen den Sauerstoff und Wasserstoffatomen kann ebenso auf weitere Wassermoleküle übertragen werden, indem sie sich mit den bisher nichtgebundenen Atomen binden und so ein Netz bilden. Wie das dann aussieht, wird in der folgenden Abbildung zu erkennen: die dunkelroten Punkte stellen Sauerstoffatome und die hell roten Punkte Wasserstoffatome dar.
Wie in der Abbildung zu sehen, gilt hier das gleiche Prinzip der Bildung von Wasserstoffbrücken, bei dem die Moleküle so ausgerichtet sind, dass jedes Wasserstoffatom an ein Sauerstoffatom grenzt und jedes Sauerstoffatom an ein Wasserstoffatom. Aufgrund dieser Anordnung entstehen Wasserstoffbrücken, die von den gepunkteten Linien repräsentiert werden.
6. Dipol-Dipol-Wechselwirkung
Bei einer Dipol-Dipol-Wechselwirkung interagieren mindestens zwei Moleküle miteinander, die jeweils einen permanenten Dipol darstellen. Diese Dipole agieren miteinander, wie bereits in Punkt 3 "Was ist ein Dipol?" erklärt. Die Stärke der Dipol-Dipol-Wechselwirkungen hängt dabei von der Entfernung und der relativen Orientierung der Partialladungen ab. Es gilt, je geringer der Abstand desto größer die dort auftretende Dipol-Dipol-Wechselwirkung.
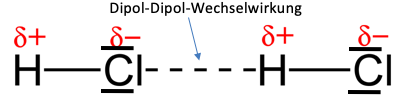
Ein Beispiel für die Dipol-Dipol-Wechselwirkung ist das Hydrogenchlorid-Molekül. Die Voraussetzungen dafür sind erstens, dass die Differenz der Elektronegativität der verbundenen Atome über 0,5 und unter 1,7 liegt (H=2,2/Cl=3,16) und es keinen zusammenfallenden Ladungsschwerpunkt gibt.
Da beide Kriterien vom Hydrogenchlorid-Molekül erfüllt werden, ziehen sich das Chloratom mit negativer Partialladung und das Wasserstoffatom mit positiver Partialladung an, wodurch die angesprochene Wechselwirkung auftritt.
In der Abbildung zu sehen sind zwei Hydrogenchlorid-Moleküle, deren Partialladungen eingezeichnet sind und sich aufgrund der Dipol-Dipol-Wechselwirkungen anziehen
7. Ion-Dipol-Wechselwirkungen (keine zwischenmolekulare Kraft im engeren Sinn)
Ion-Dipol-Wechselwirkungen beschreiben die Kräfte, die zwischen Ionen und geladenen Molekülen entstehen. Sie zählen nicht zu den zwischenmolekularen Kräften im engeren Sinn, entstehen jedoch nach dem gleichen Prinzip und sind auch sonst den eigentlichen zwischenmolekularen Kräften sehr ähnlich.
Wie der Name schon sagt, werden dafür Ionen und Moleküle mit permanentem Dipolmoment benötigt. Dadurch, dass das Ion entweder positiv oder negativ geladen ist, wird der gleiche Anziehungseffekt wie bei zwei Dipolen hervorgerufen. Die resultierende Anziehung entsteht nach dem gleichen Prinzip wie "normale" Dipol-Dipol-Wechselwirkungen.
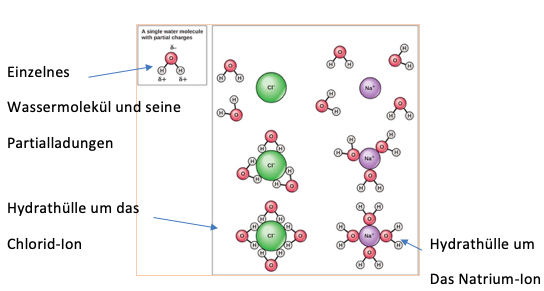
Ein Paradebeispiel dafür ist die Hydration von Ionen, bei der die Wassermoleküle sich an Anionen und Kationen von den Sauerstoffatomen der Wassermoleküle, die eine negative Partialladung haben, umgeben, während die Anionen von den Wasserstoffatomen, welche positive Partialladungen besitzen, umgeben werden.
Genau dieser Effekt der Hydration ist wiederzufinden, wenn man Kochsalz (NaCl -solid-) in Wasser gibt. Wie in der Abbildung zu sehen, werden die negativ geladenen Chlorid-Ionen von den positiv geladenen Natrium-Ionen getrennt und die Salzkristalle lösen sich auf. Da die Ionen geladen sind und die Wassermoleküle ein Dipolmoment haben, ziehen sie sich zwei Dipole bei der Dipol-Dipol-Wechselwirkungen an. Die Chlorid-Ionen werden von den partial positiv geladenen Wasserstoffatomen umgeben, während die Natrium-Ionen von den partial negativ geladenen Sauerstoffatomen der Wassermoleküle umgeben werden und sich Hydrathüllen bilden.
8. Überblick mit Alltagsbezug
Da ihr den Text durchgelesen habt, solltet ihr nun einiges über die vorgestellten zwischenmolekularen Kräfte der Chemie und die Ion-Dipol-Wechselwirkung wissen. Zum Abschluss noch eine kurze Zusammenfassung.
Angefangen mit den Van-der-Waals-Kräften, die durch temporäre und induzierte Dipole entstehen und deren Anziehungskraft bei etwa 0,5-5 kJ/mol liegt, wurden ebenfalls die Dipol-Dipol-Wechselwirkungen vorgestellt. Diese werden durch mindestens zwei asymmetrische Moleküle hervorgerufen, die einen Dipol darstellen und sich gegenseitig anziehen. Die Stärke ihrer Anziehungskräfte liegen bei 2-10 kJ/mol. Des Weiteren wurden die Wasserstoffbrücken behandelt, die ein besonders starker Sonderfall der Dipol-Dipol-Wechselwirkungen sind und sich auf die gleiche Weise bilden. Nicht ohne Grund besitzen sie mit 10-20 kJ/mol die stärkste Anziehungskraft der zwischenmolekularen Kräfte. Die letzte erläuterte Wechselwirkung ist die Ion-Dipol-Wechselwirkung, welche statt zwei Dipolen nur einen benötigt und ein Ion, um das sich eine Hydrathülle bildet.
Die zwischenmolekularen Kräfte haben unterschiedlich starke Anziehungskräfte, die in bestimmten bereits angegebenen Bereichen variieren. Die Van-der-Waals-Kräfte gelten allgemein als schwächste zwischenmolekulare Kraft, gefolgt von der Dipol-Dipol-Wechselwirkung. Die Wasserstoffbrücken haben vergleichsweise mit Abstand die stärksten Anziehungskräfte, was nicht überraschend ist, da sie als starke Dipol-Dipol-Wechselwirkungen gelten.
Diese Kräfte sind auch oftmals im Alltag wiederzufinden. Bekannte Beispiele dafür sind Tiere, denen es möglich ist, an Wänden und Decken zu gehen, ohne dabei herunter zu fallen. Der Gecko ist eines dieser Tiere, der sich die Van-der-Waals-Kräfte für diesen Zweck zu Nutze macht. Aufgrund von seinen unzähligen Härchen auf den Hand- und Fußoberflächen, die mithilfe der Van-der-Waals-Kräfte bei jedem Schritt angezogen werden, ist es ihm möglich, in allen möglichen Lagen zu gehen, ohne runter zu fallen.
Übungsaufgaben
Laden
Weitere Aufgaben zum Thema findest du im folgenden Aufgabenordner:
Aufgaben zu chemischen Bindungen
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
Artikel
- Arten der Zwischenmolekulare Kräfte
- Wasserstoffbrückenbindungen (Zwischenmolekulare Kräfte)
- Van-Der-Waals Kräfte (Zwischenmolekulare Kräfte)