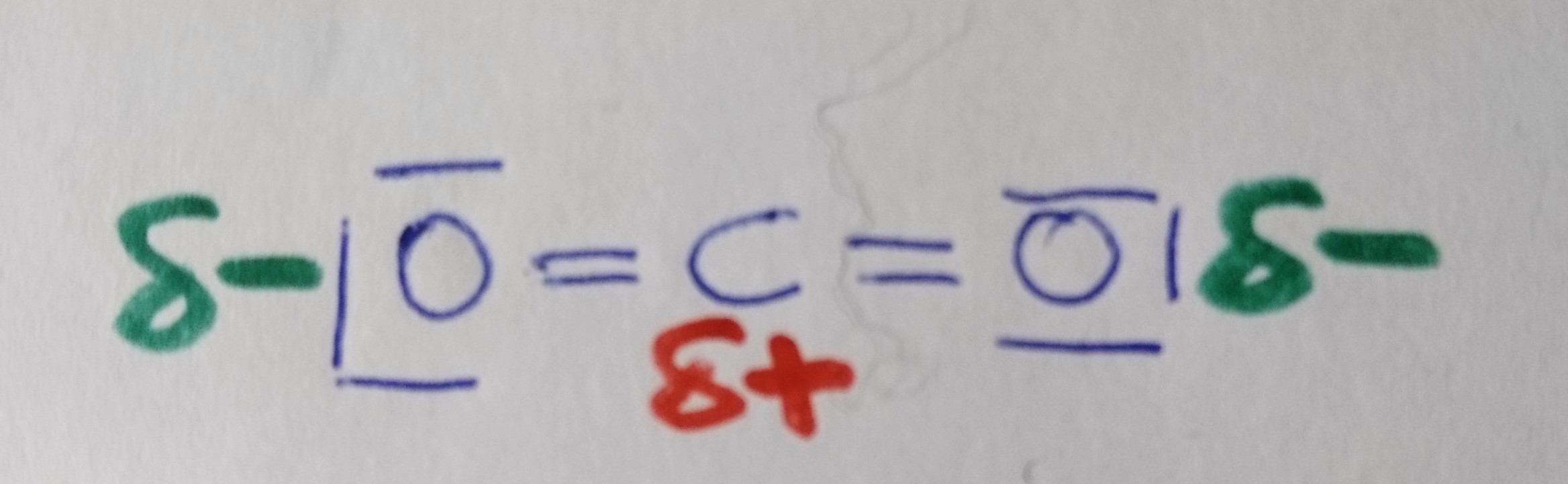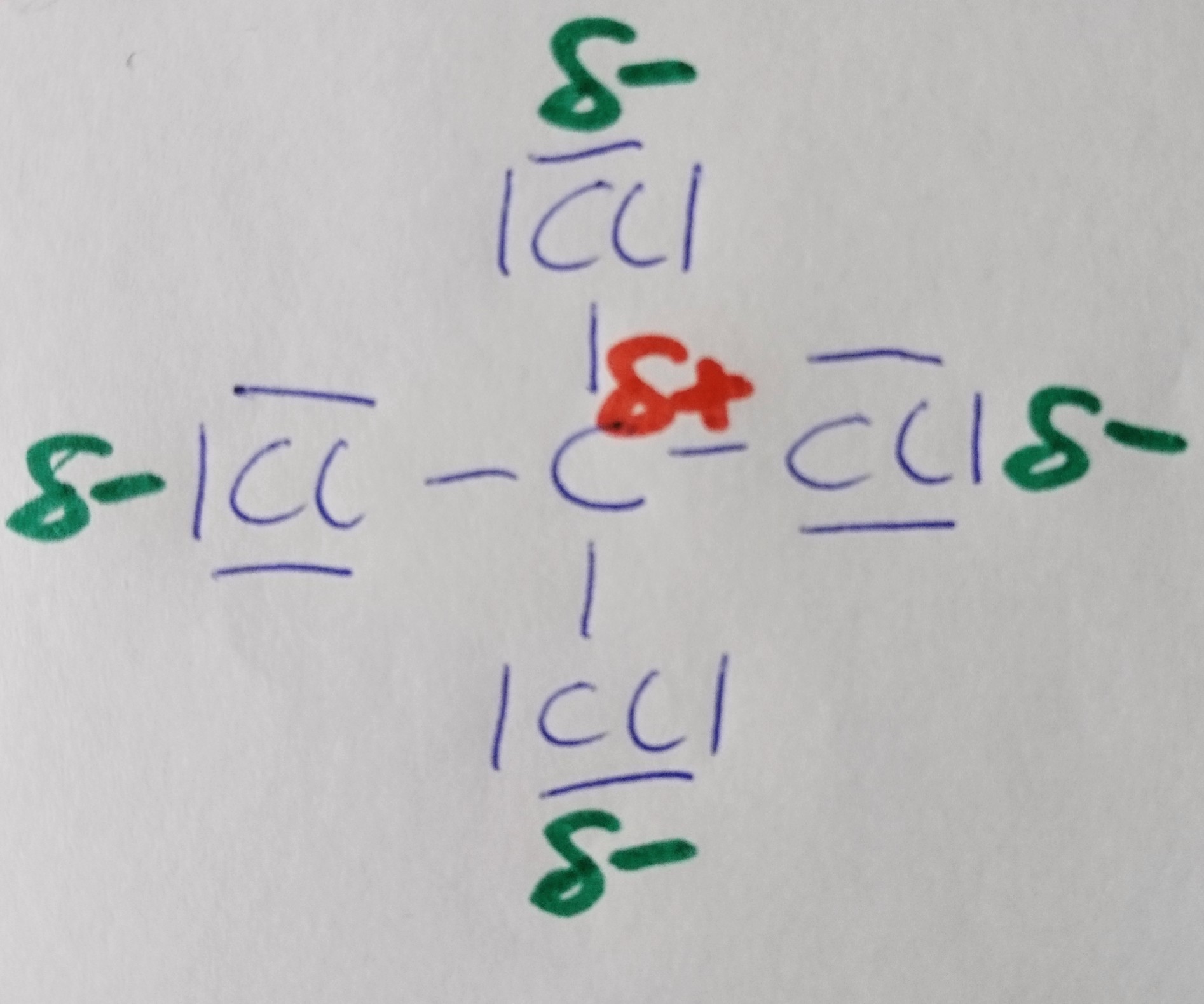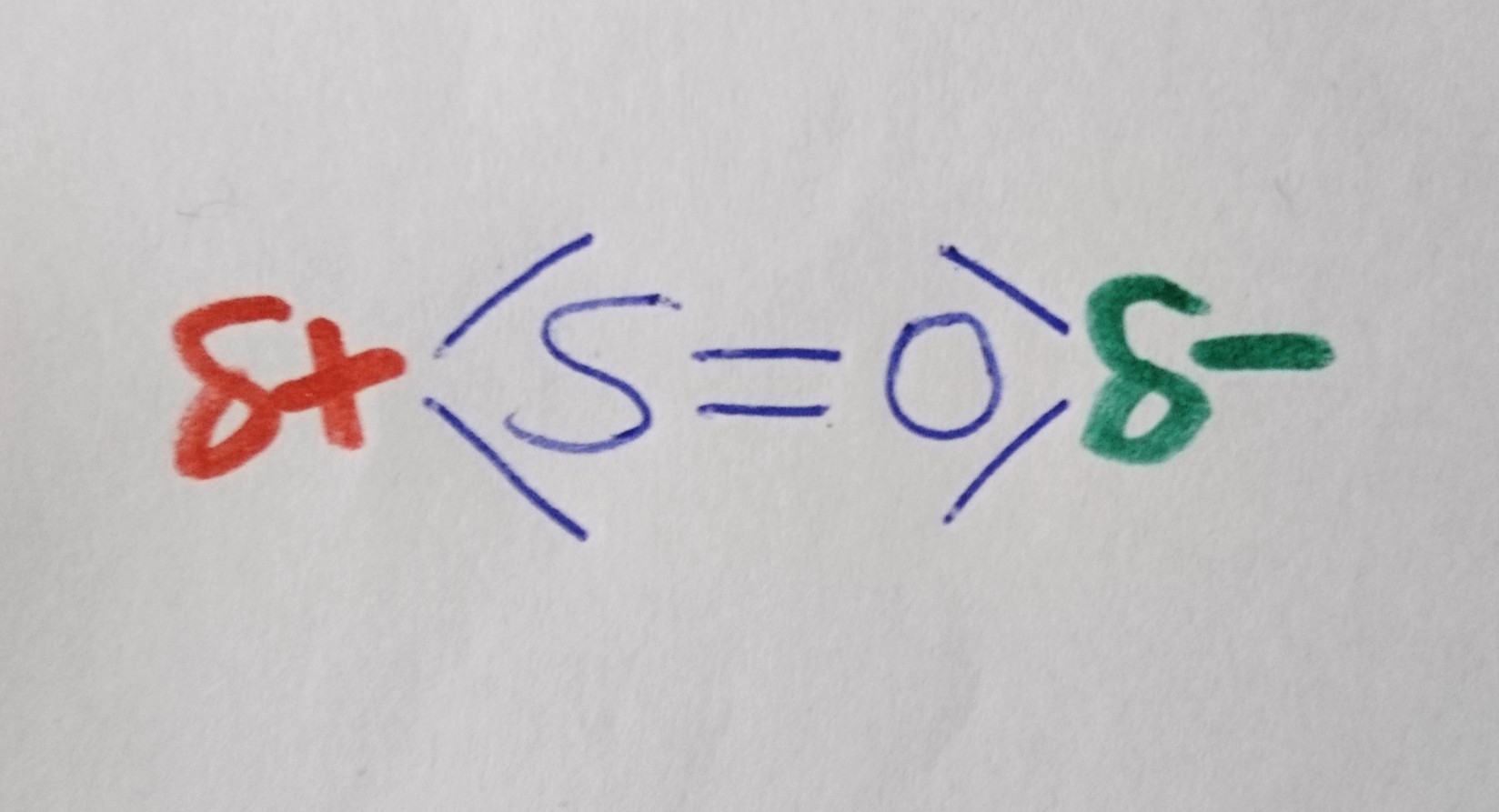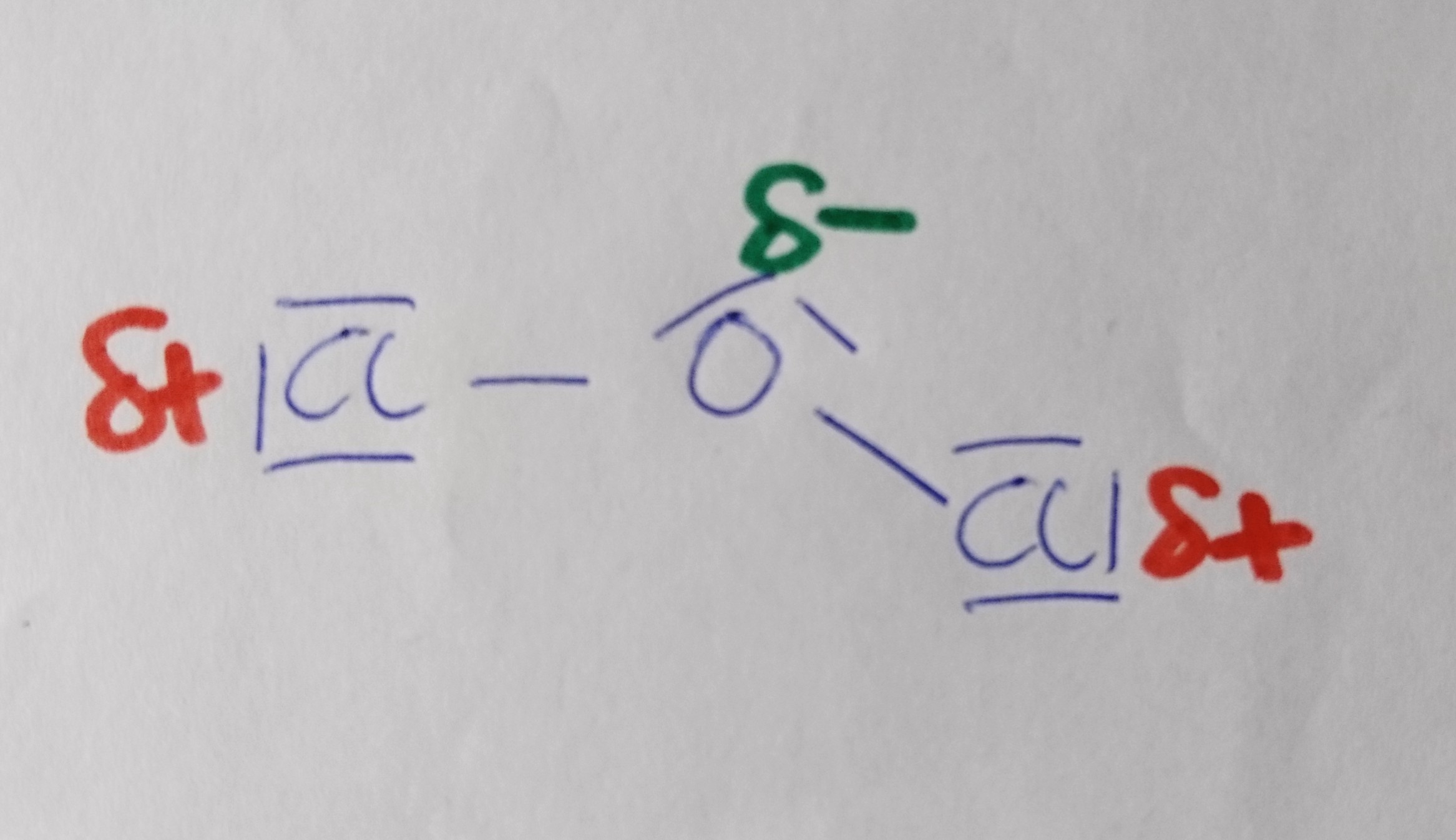Aufgaben zu chemischen Bindungen
Lass dir keinen Bären (chemisch) aufbinden! Hier findest du Übungsaufgaben zum Thema chemischen Bindungen.
- 1
Gib die Summenformeln folgender Moleküle an und erkläre ob ein Dipol vorliegt oder nicht.
Wasser
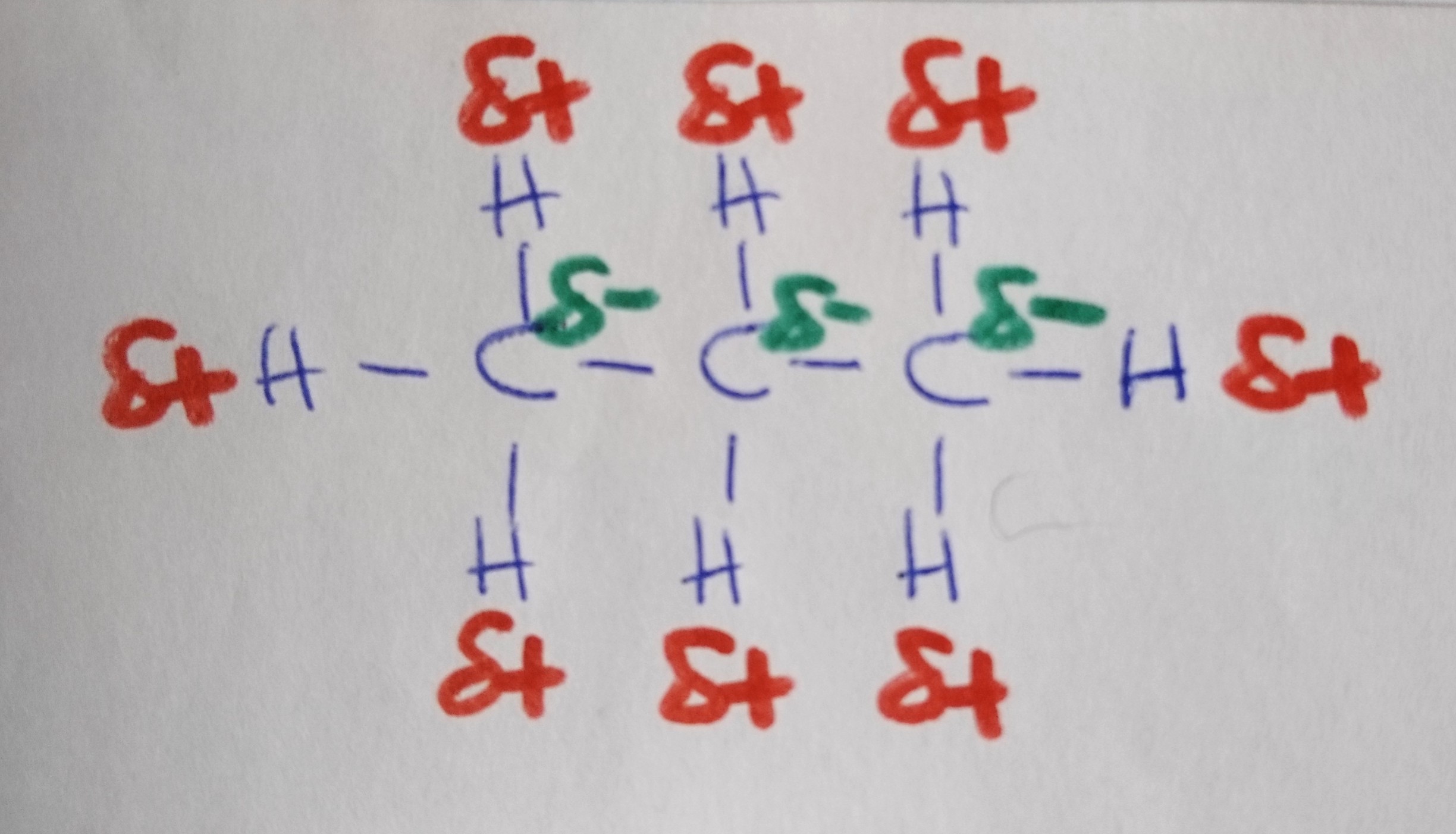
Propan
Kohlenstoffdioxid
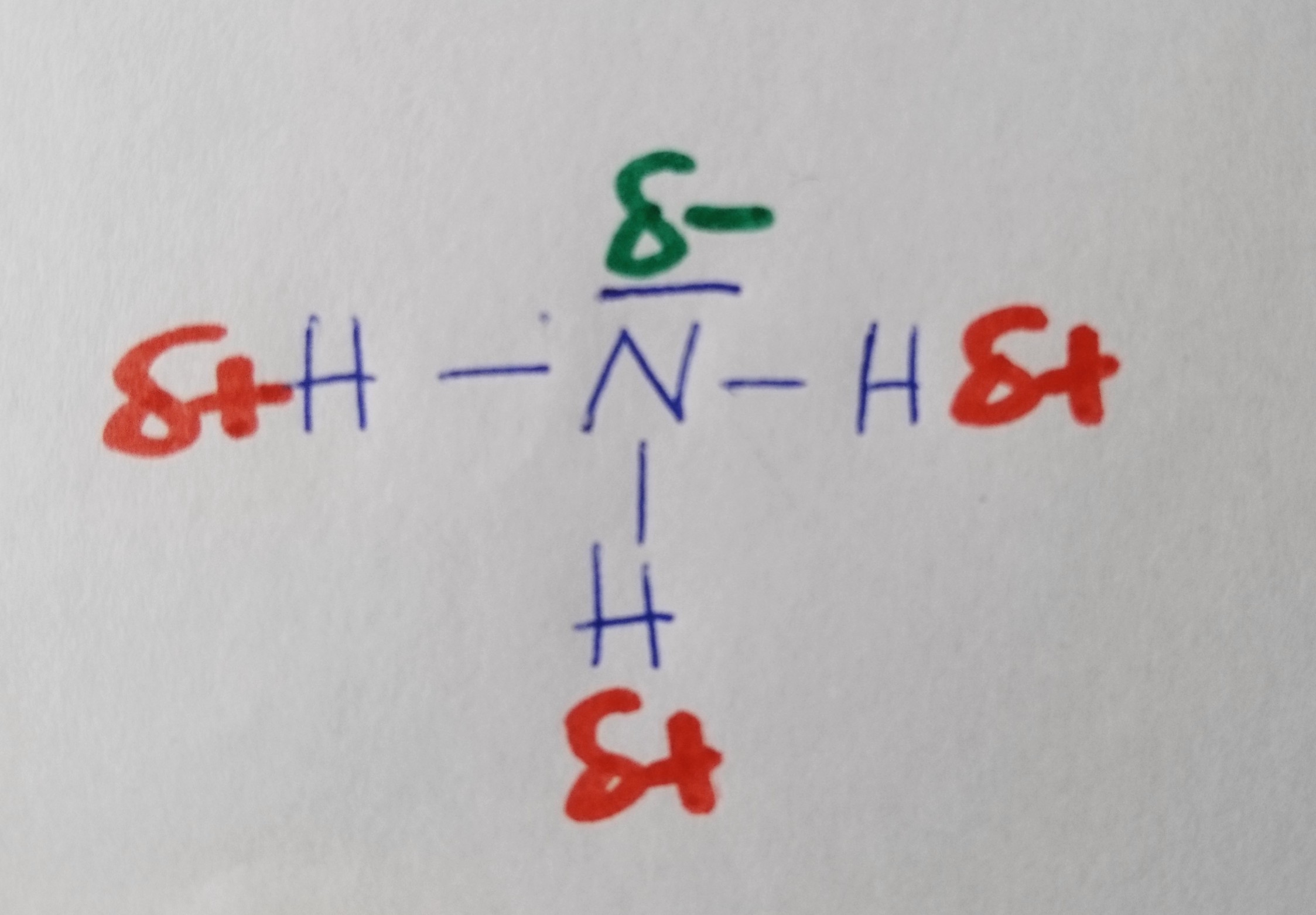
Ammoniak
Kohlenstofftetrachlorid
Schwefelmonoxid
Dichlormonoxid
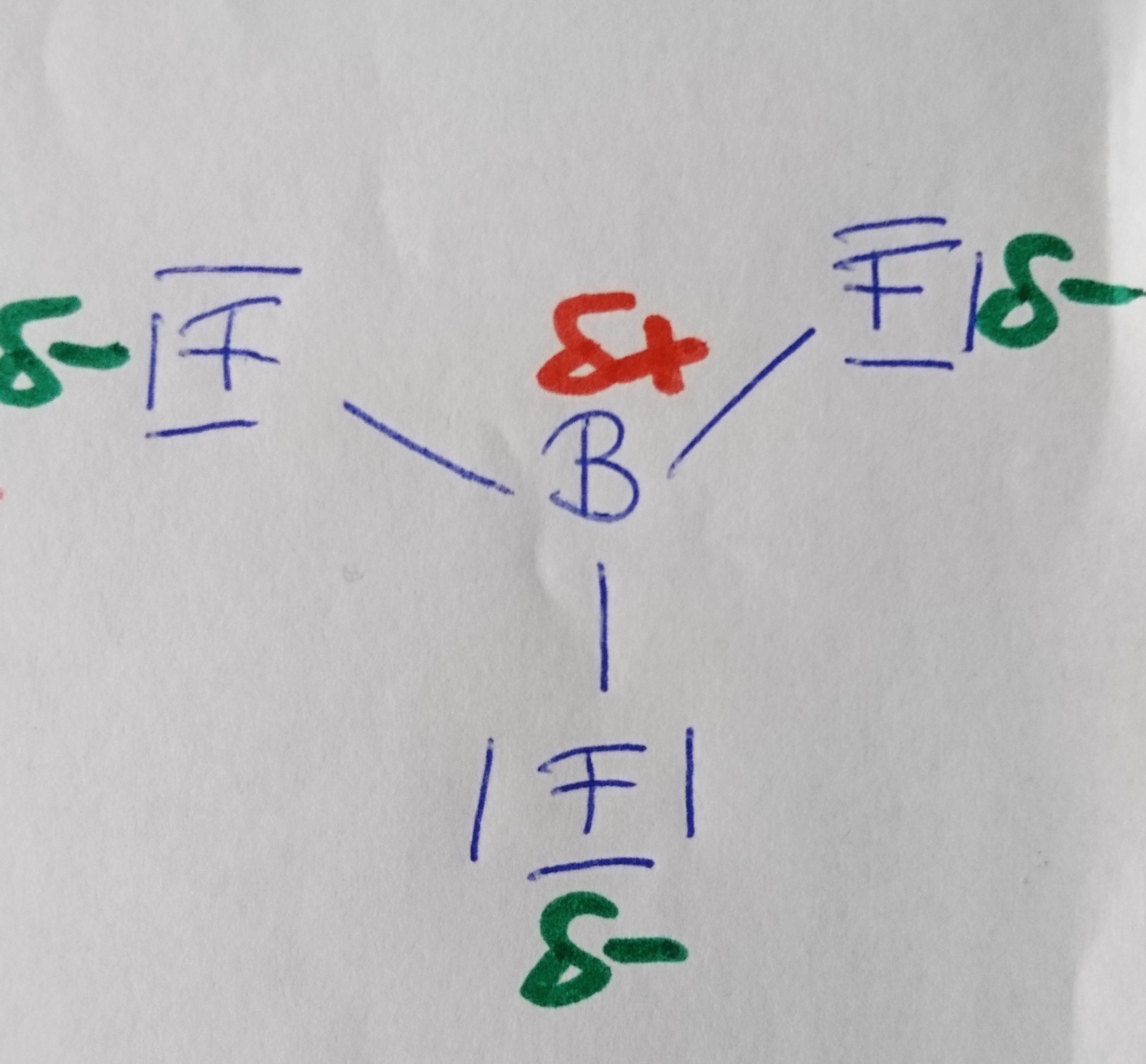
Bortrifluorid
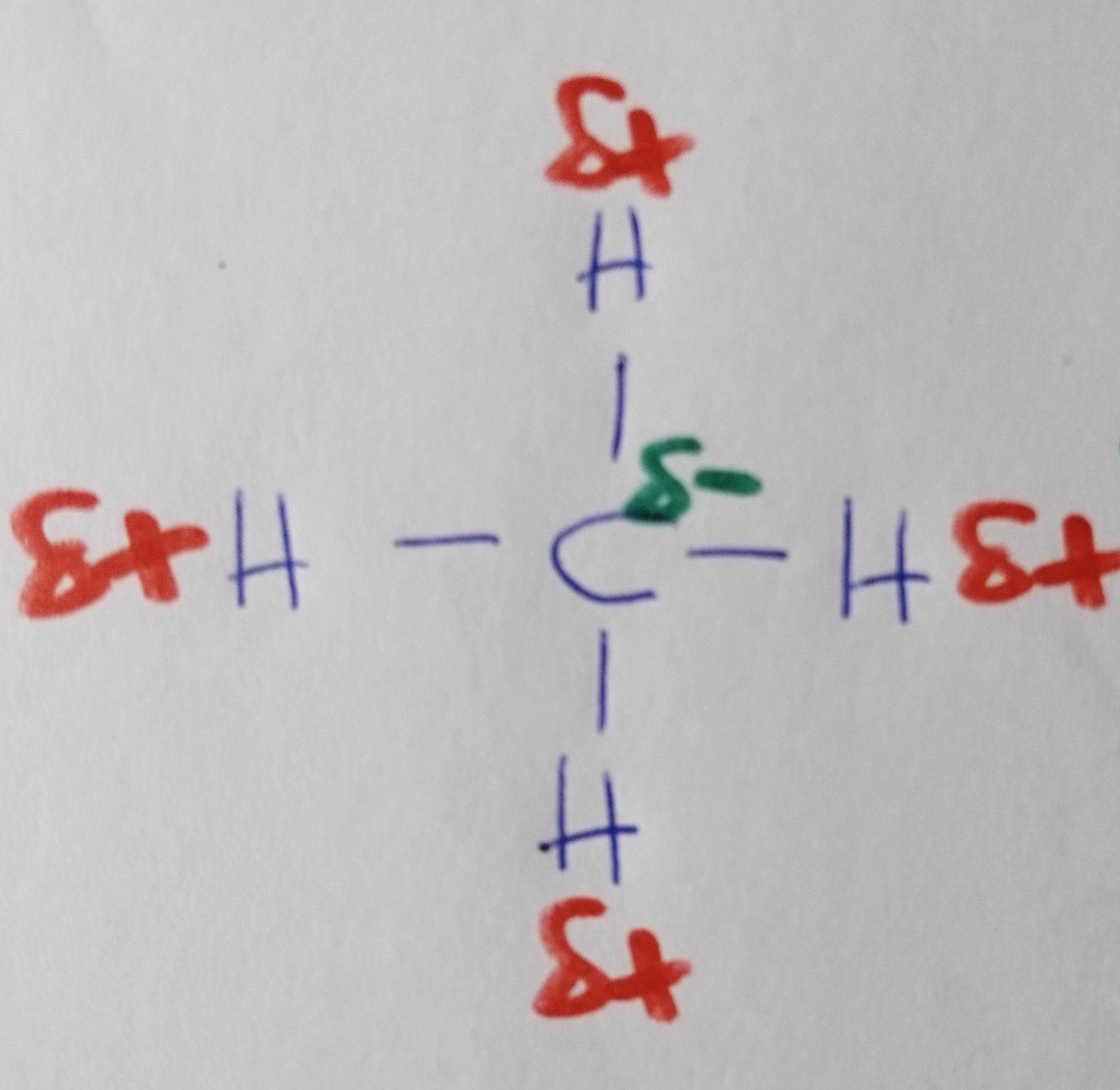
Methan
- 2
Bestimme die Namen für die folgenden Verbindungen.
- 3
Gib die Summenformel für die Verbindungen mit den folgenden Namen an.
Diarsenpentoxid
Magnesiumdibromid
- 4
Welche Elemente treten nie alleine, sondern immer nur paarig auf?
- 5
Wann liegt ein Dipol vor?
- 6
Welche Wechselwirkung liegt zwischen den folgenden Molekülen vor?
Zwei Schwefeldioxid-Moleküle
Zwei Wasserstoff-Moleküle
Zwei Methanol-Moleküle
- 7
Welche dieser intermolekularen Kräfte ist die stärkste?
- 8
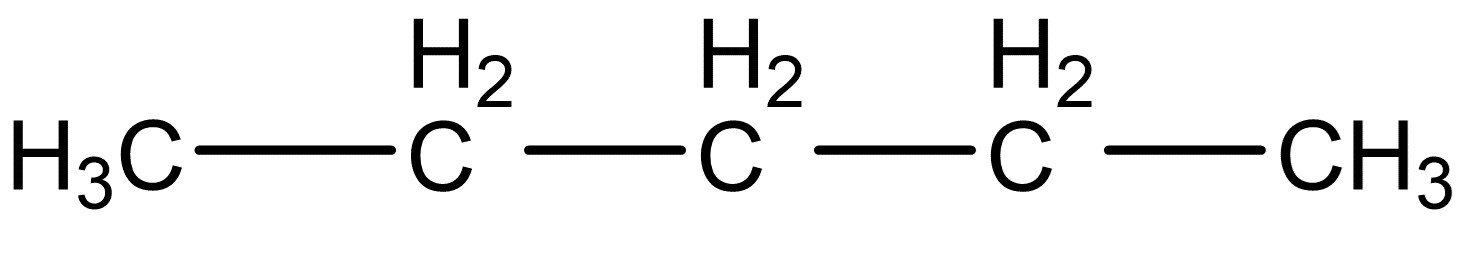
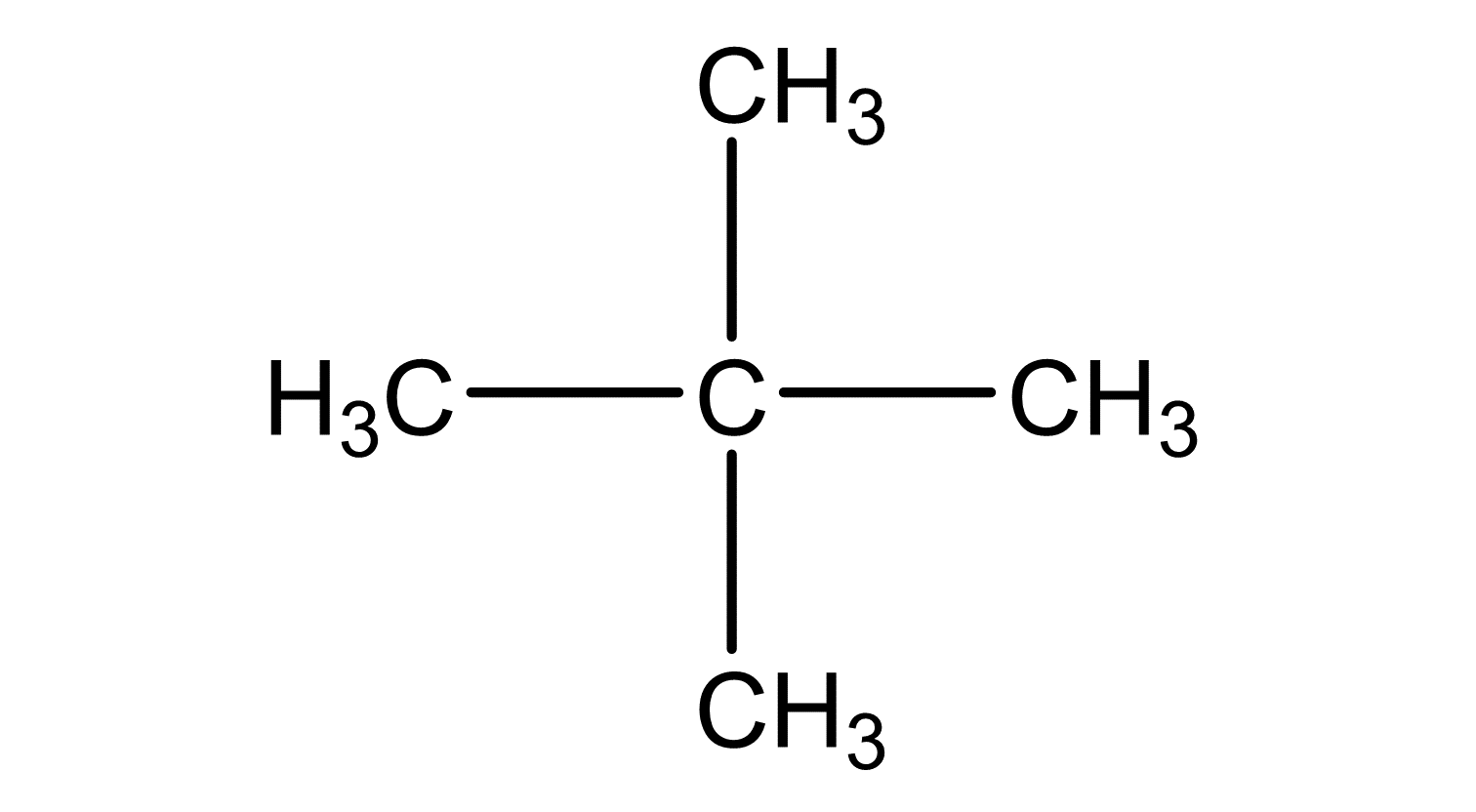
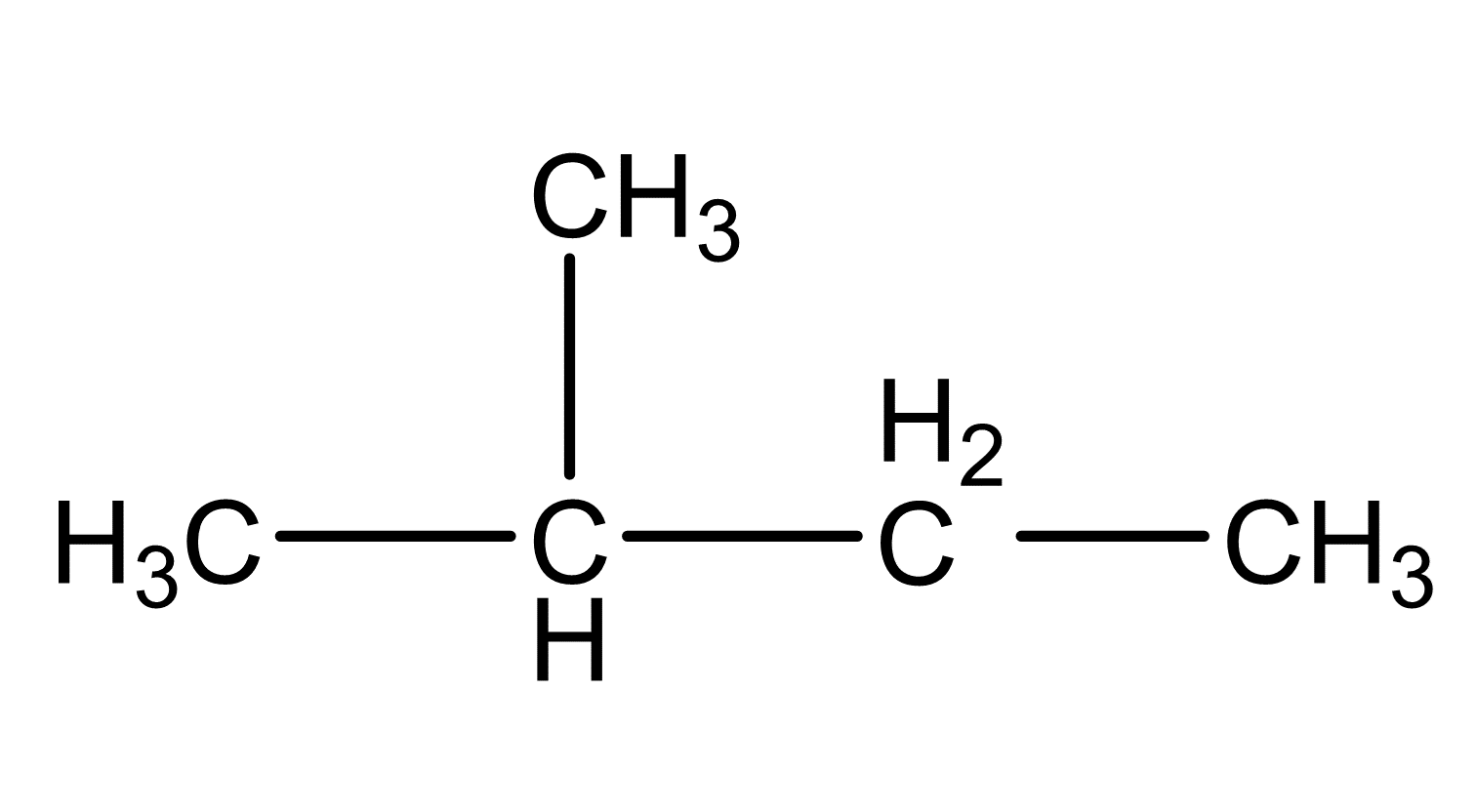
Zeichne die folgenden Isomere von dem Kohlenwasserstoff Pentan in Valenzschreibweise.
Pentan
2-Methylbutan
2,2-Dimethylpropan
Ordne danach die folgenden Siedetemperaturen zu den passenden Strukturen und begründe.
9,5°C
28°C
36°C
- 9
Welche der folgenden Eigenschaften ist keine Eigenschaft von ionischen Verbindungen?
Dieses Werk steht unter der freien Lizenz
CC BY-SA 4.0 → Was bedeutet das?