Bestimme für die folgenden Redoxreaktionen jeweils die Teilgleichungen für Oxidation und Reduktion. Die Reaktionen laufen im basischen Milieu ab.
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen
Bestimmen der Oxidationszahlen.
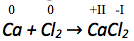
Betrachtung der Oxidationszahlen auf Edukt- und Produktseite der jeweils zusammengehörenden Atome.
Oxidation
Vergrößert sich die Oxidationszahl des Atoms so handelt es sich um die
Oxidation.
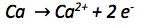
Die Oxidationszahl des Calciumatoms vergrößert sich von 0 auf +II. Es werden also abgegeben. Abgegebene Elektronen werden auf die rechte Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall sind die Ladungen bereits durch das -Ion ausgeglichen.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Ein Stoffausgleich ist hier nicht nötig.
Reduktion
Verkleinert sie sich, so handelt es sich um die Reduktion.
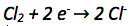
Die Oxidationszahl der Chloratome verkleinert sich von 0 auf -I. Es werden also aufgenommen. Aufgenommene Elektronen werden auf die linke Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall sind die Ladungen bereits durch die -Ionen ausgeglichen.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Ein Stoffausgleich ist hier nicht nötig.
Hast du eine Frage oder Feedback?
Bestimme zunächst die Oxidationszahlen.
Überlege dir danach welche Teilreaktionen es gibt und bei welcher es sich um die Reduktion beziehungsweise Oxidation handelt.
Um die Teilgleichungen vollständig aufzustellen musst du folgende Schritte beachten.
Elektronen aufschreiben
Ladungsausgleich
Stoffausgleich
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen lösen
Bestimmen der Oxidationszahlen.
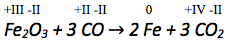
Betrachtung der Oxidationszahlen auf Edukt- und Produktseite der jeweils zusammengehörenden Atome.
Oxidation
Vergrößert sich die Oxidationszahl des Atoms so handelt es sich um die
Oxidation.
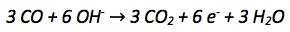
Die Oxidationszahl des Kohlenstoffatoms vergrößert sich von +II auf +IV. Es werden also abgegeben. Abgegebene Elektronen werden auf die rechte Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall müssen Sechs negative Ladungen der Elektronen ausgeglichen mithilfe von -Ionen werden.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Für den Stoffausgleich werden Wassermoleküle verwendet.
Reduktion
Verkleinert sie sich, so handelt es sich um die Reduktion.
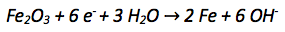
Die Oxidationszahl der Eisenatome verkleinert sich von +III auf 0. Es werden also aufgenommen. Aufgenommene Elektronen werden auf die linke Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall müssen 6 negative Ladungen der Elektronen durch -Ionen ausgeglichen werden.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Der Stoffausgleich findet mit Wassermolekülen statt.
Hast du eine Frage oder Feedback?
Bestimme zunächst die Oxidationszahlen.
Überlege dir danach welche Teilreaktionen es gibt und bei welcher es sich um die Reduktion beziehungsweise Oxidation handelt.
Um die Teilgleichungen vollständig aufzustellen musst du folgende Schritte beachten.
Elektronen aufschreiben
Ladungsausgleich
Stoffausgleich
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen
Bestimmen der Oxidationszahlen.
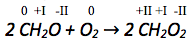
Betrachtung der Oxidationszahlen auf Edukt- und Produktseite der jeweils zusammengehörenden Atome.
Oxidation
Vergrößert sich die Oxidationszahl des Atoms so handelt es sich um die
Oxidation.
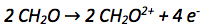
Die Oxidationszahl des Kohlenstoffatoms vergrößert sich von +II auf +IV. Es werden also pro Kohlenstoffatom abgegeben. Da es zwei Kohlenstoffatome gibt werden insgesamt abgegeben. Abgegebene Elektronen werden auf die rechte Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall muss nicht ausgeglichen werden.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Für den Stoffausgleich werden Wassermoleküle verwendet. Hier ist kein Stoffausgleich nötig.
Reduktion
Verkleinert sich die Oxidationszahl des Atoms so handelt es sich um die Reduktion.
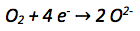
Die Oxidationszahl der Sauerstoffatome verkleinert sich von 0 auf -II. Es werden also pro Sauerstoffatom abgegeben. Da es zwei Sauerstoffatome gibt werden insgesamt abgegeben.. Aufgenommene Elektronen werden auf die linke Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall ist die Gleichung bereits ausgeglichen.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Der Stoffausgleich findet mit Wassermolekülen statt. Hier ist kein Stoffausgleich nötig.
Hast du eine Frage oder Feedback?
Bestimme zunächst die Oxidationszahlen.
Überlege dir danach welche Teilreaktionen es gibt und bei welcher es sich um die Reduktion beziehungsweise Oxidation handelt.
Um die Teilgleichungen vollständig aufzustellen musst du folgende Schritte beachten.
Elektronen aufschreiben
Ladungsausgleich
Stoffausgleich
Dieses Werk steht unter der freien Lizenz
CC BY-SA 4.0 → Was bedeutet das?
