Dieser Artikel erklärt, was eine chemische Reaktion ist, was dabei auf der Teilchenebene passiert und was der Massenerhaltungssatz aussagt.
Eine chemische Reaktion unterscheidet sich von einem physikalischen Vorgang durch eine Stoffumwandlung. Das heißt, die kleinsten Teilchen eines Stoffes ändern sich.
Verdampfen ist zum Beispiel nur ein physikalischer Vorgang, dabei bleiben die kleinsten Teilchen des Stoffs, bei Wasser die Wassermoleküle (), unverändert.
Wenn wir uns aber die Reaktion von Wasserstoff (), und Sauerstoff (), anschauen, ist das nicht der Fall. Die Atome werden auseinandergerissen und neu zusammengesetzt: Es entsteht ein neuer Stoff. Der neue Stoff, der bei dieser Reaktion entsteht, ist Wasser (). Aus zwei elementaren Reinstoffen entsteht also eine Verbindung:
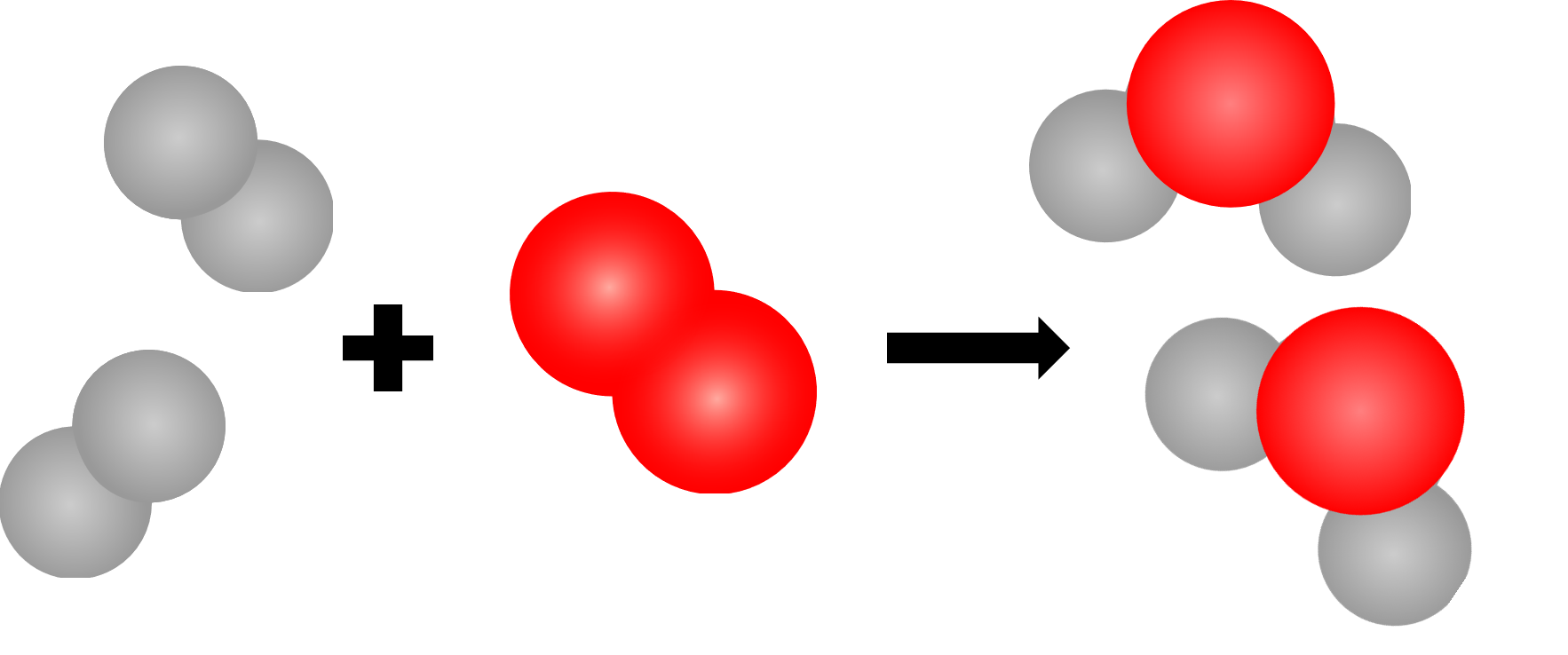
Die Anzahl der Atome bleibt aber unverändert, es werden keine Atome zerstört oder neu erschaffen. Daher haben alle Teilchen zusammen vor der Reaktion die gleiche Masse wie alle Teilchen zusammen nach der Reaktion. Diese Tatsache beschreibt der Massenerhaltungssatz:
Während einer chemischen Reaktion bleibt die Gesamt-Masse aller beteiligten Stoffe konstant.
Den Massenerhaltungssatz müssen wir immer berücksichtigen. Daher brauchen wir für die Reaktion zwei Wasserstoffmoleküle und erhalten auch zwei Wassermoleküle, brauchen aber nur ein Sauerstoffmolekül.
Bei einer chemischen Reaktion werden die ursprünglichen Stoffe als Edukte (Ausgangsstoffe) und die nach Ablauf der Reaktion vorliegenden Stoffe als Produkte (Endstoffe) bezeichnet. Wasserstoff und Sauerstoff sind in unserem Beispiel die Edukte, Wasser das Produkt.
