5Kollisionstheorie
Die Kollisionstheorie ist eine einfache Theorie, um die Reaktionsgeschwindigkeit anschaulich zu erklären. Die Teilchen werden dazu als starre Körper angesehen, die sich bewegen. Wenn die Teilchen zusammenstoßen, erfolgt eine chemische Reaktion. Je öfters und je heftiger die Teilchen zusammenstoßen, desto schneller ist die Reaktion. Damit es eine Reaktion gibt, müssen die richtigen Teilchen mit genügend Energie zusammenstoßen. Nicht alle Teilchen bewegen sich gleich schnell und nicht jeder Zusammenstoß führt zu einer Reaktion.
Wir betrachten dafür die Reaktion von Wasserstoff und Sauerstoff. Stoßen Wasserstoffmoleküle und ein Sauerstoffmolekül mit genügend Energie zusammen, reagieren Sie zu Wassermolekülen. (

Was passiert, wenn zwei Wasserstoffmoleküle zusammenstoßen?
Erkläre mit der Kollisionstheorie und den Abbildungen die Beeinflussung der Reaktionsgeschwindigkeit durch:
a) die Konzentrationsabhängigkeit

b) den Zerteilungsgrad
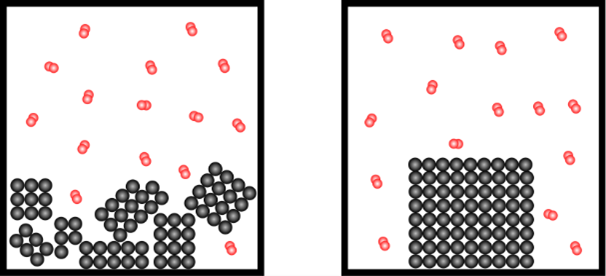
c) die Temperatur
