Chemische Reaktionen grenzen sich von physikalischen Vorgängen dadurch ab, dass eine Stoffumwandlung passiert. Die Stoffumwandlung kann jedoch nur stattfinden, wenn gewisse Bedingungen erfüllt sind.
Ein zweites wesentliches Merkmal einer chemischen Reaktion ist der Energieumsatz. Während einige Reaktionen stetige Energiezufuhr benötigen, liefern andere während ihres Verlaufs Energie.
Reaktionsenergie
Die Energie, welche freigesetzt oder benötigt wird, wenn chemische Bindungen gebrochen und neu gebildet werden, nennen wir Reaktionsenergie. Sie ist abhängig von den Edukten, das heißt den Stoffen, die zusammen reagieren und der Art der chemischen Bindung im Produkt. Für das Aufbrechen von Bindungen wird dabei Energie benötigt, das Ausbilden von Bindungen setzt hingegen Energie frei.
Reaktionsenthalpie
Die Wärme, die von einem System unter konstantem Druck aufgenommen oder abgegeben wird, verändert eine Eigenschaft des Systems, die man als Enthalpie (H) bezeichnet. Deshalb wird die Energie, die bei chemischen Reaktionen umgesetzt wird, auch als Reaktionsenthalpie bezeichnet.
Aktivierungsenergie
Machen wir ein Beispiel: Stell dir vor, du willst ein Feuer machen. Dabei schichtest du Holz zu einem Haufen. Nun beginnt dieser Haufen Holz aber nicht von alleine zu brennen, also nimmst du ein Streichholz und entzündest den Haufen, was zu einem gemütlichen Feuer wird.
Wie dieses Beispiel zeigt, laufen auch energieliefernde Reaktionen nicht von allein ab. Wir müssen am Anfang kurz Energie zuführen, um die Reaktion in Gang zu setzen. Die dazu erforderliche Energie heißt Aktivierungsenergie. Sie ist immer erforderlich, egal ob bei der anschließend ablaufenden Reaktion Energie verbraucht oder frei wird. Den Energieunterschied zwischen Edukten und Produkten nennen wir Reaktionsenergie.
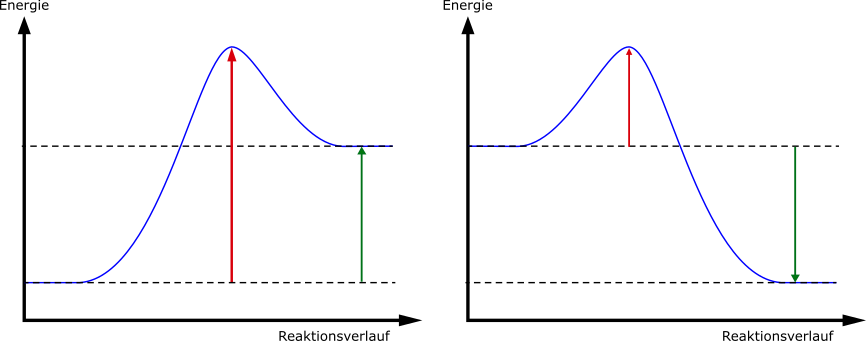
Energiediagramm
Wie sich die Energie während einer chemischen Reaktion ändert, stellen wir in einem Energiediagramm graphisch dar. Die y-Achse ist dabei die Energie und die x-Achse stellt den Reaktionsverlauf dar.
Wir unterscheiden dabei zwischen zwei Arten von Reaktionen, je nachdem, ob in den Produkten oder Edukten mehr Energie steckt. Wenn bei einer chemischen Reaktion Energie frei wird, das heißt, in den Produkten steckt weniger Energie als in den Edukten, dann nenne wir die Reaktion exotherm. Eine Reaktion, bei der in den Produkten mehr Energie steckt als in den Edukten, nennen wir endotherm. Die Reaktionsenergie einer exothermen Reaktion hat ein negatives Vorzeichen, die einer endothermen Reaktion ein positives Vorzeichen.
Die Aktivierungsenergie hingegen ist immer positiv, da sie in jedem Fall aufgewendet werden muss, damit eine Reaktion ablaufen kann.
Aufgabe: Zeichne das Energiediagramm für die Reaktion von Wasserstoff mit Sauerstoff.
Die dritte wichtige Eigenschaft chemischerReaktionen ist, dass sie im Prinzip umkehrbar sind. Unter ganz bestimmten Bedingungen lassen sich die Produkte wieder in die Edukte zurückführen. Wird eine Reaktion umgekehrt, wird genau gleich viel Energie umgesetzt, jedoch ändert sich das Vorzeichen der Reaktionsenergie. Wollten wir eine exotherme Reaktion umkehren, müssten wir genau so viel Energie reinstecken, wie frei wird, wenn diese abläuft. Dieses Prinzip wird Energieerhaltungssatz genannt. Würde dies nicht gelten, so könnte man durch wiederholende Umkehrung einer Reaktion Energie erzeugen (Perpetuum Mobile), was nicht möglich ist.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
