Anders als Stoffe und deren Portionen im Alltag (z.B. 100g Mehl), ist die Bestimmung der Massen von beispielsweise Atomen nicht so simpel. In diesem Artikel erfährst du, wie das funktioniert.
Die Bestimmung der Masse von Stoffportionen (z.B. 100 g Zucker) ist dank der Waage kein Problem. Die Massenbestimmung von kleinsten Stoffteilchen, Atomen, Molekülen oder Ionen ist mit dieser Methode jedoch nicht möglich. Beispielsweise beträgt die Atommasse eines Wasserstoffatoms:
Gleichung (1)
Um nicht mit solchen unhandlichen Werten arbeiten zu müssen und damit zwischen verschiedenen Teilchen ein Vergleich möglich ist, wurde die atomare Masseneinheit (Unit) eingeführt. Sie entspricht ungefähr der Masse eines Wasserstoffatoms (bzw. eines Protons), festgelegt wurde folgende Definition:
Gleichung (2)
D.h.: entspricht einem Zwölftel der Masse eines Atoms des Kohlenstoff-Isotops.
Dieser Wert kann, neben der Ordnungszahl, dem Periodensystem der Elemente (PSE) für jedes Element als durchschnittliche Atommasse entnommen werden.

Abb. 1: Wasserstoff im Periodensystem (gezeichnet mit Google Docs)
Wie erfolgt diese Massenbestimmung?
Mithilfe des Massenspektrometers ist es möglich, diese Massen sehr genau zu messen. Das Prinzip wird nachfolgend erklärt.
a) Prinzip: Erklärung mittels eines Modellversuchs:
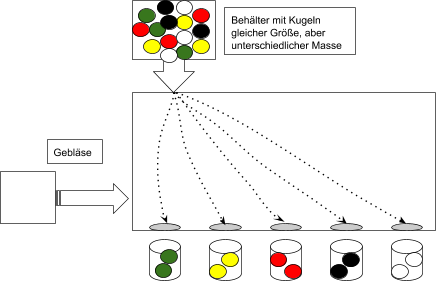
Abb. 2: Modellversuch zur Arbeitsweise eines Massenspektrometers (gezeichnet mit Google Docs)
Zwischenfrage:
Erläutere anhand von Abb. 1 die Funktionsweise dieses Modellversuches!
b) Tatsächlicher Aufbau eines Massenspektrometers:
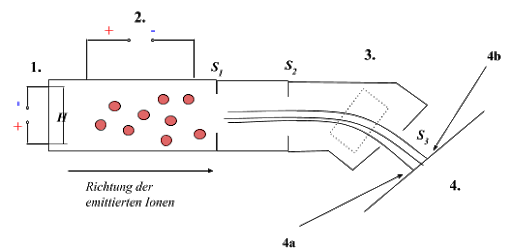
Abb. 3: Schematische Darstellung eines Massenspektrometers (gezeichnet mit Google Docs)
Erläuterungen zu Abb. 3:
Nummer in Abbildung | Erklärung |
|---|---|
Ionisierungsquelle; von Heizwendel H emittierte Elektronen treffen auf Gasmoleküle der verdampften Stoffprobe und erzeugen positiv geladene | |
Beschleunigung der Kationen anhand eines elektrischen Feldes | |
Blenden zur Bündelung der Kationen | |
Fotoplatte (Auftreffpunkt der Ionen) |
Gib an, Ionen welcher Masse bei den Punkten bzw. auftreffen!
Positiv geladene Ionen werden emittiert und anschließend in einem elektrischen Feld beschleunigt. In einem Magnetfeld erfolgt anschließend eine Ablenkung, die je nach Masse unterschiedlich stark ist.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
