Das Schalenmodell (oder auch Atommodell nach Bohr) begründet auf der Annahme, dass die Elektronen den Atomkern in bestimmten Abständen umkreisen. Diese Aufenthaltsräume werden Schalen genannt. Sie werden ausgehend vom Atomkern K-, L-, M-, N- Schale usw. bezeichnet.
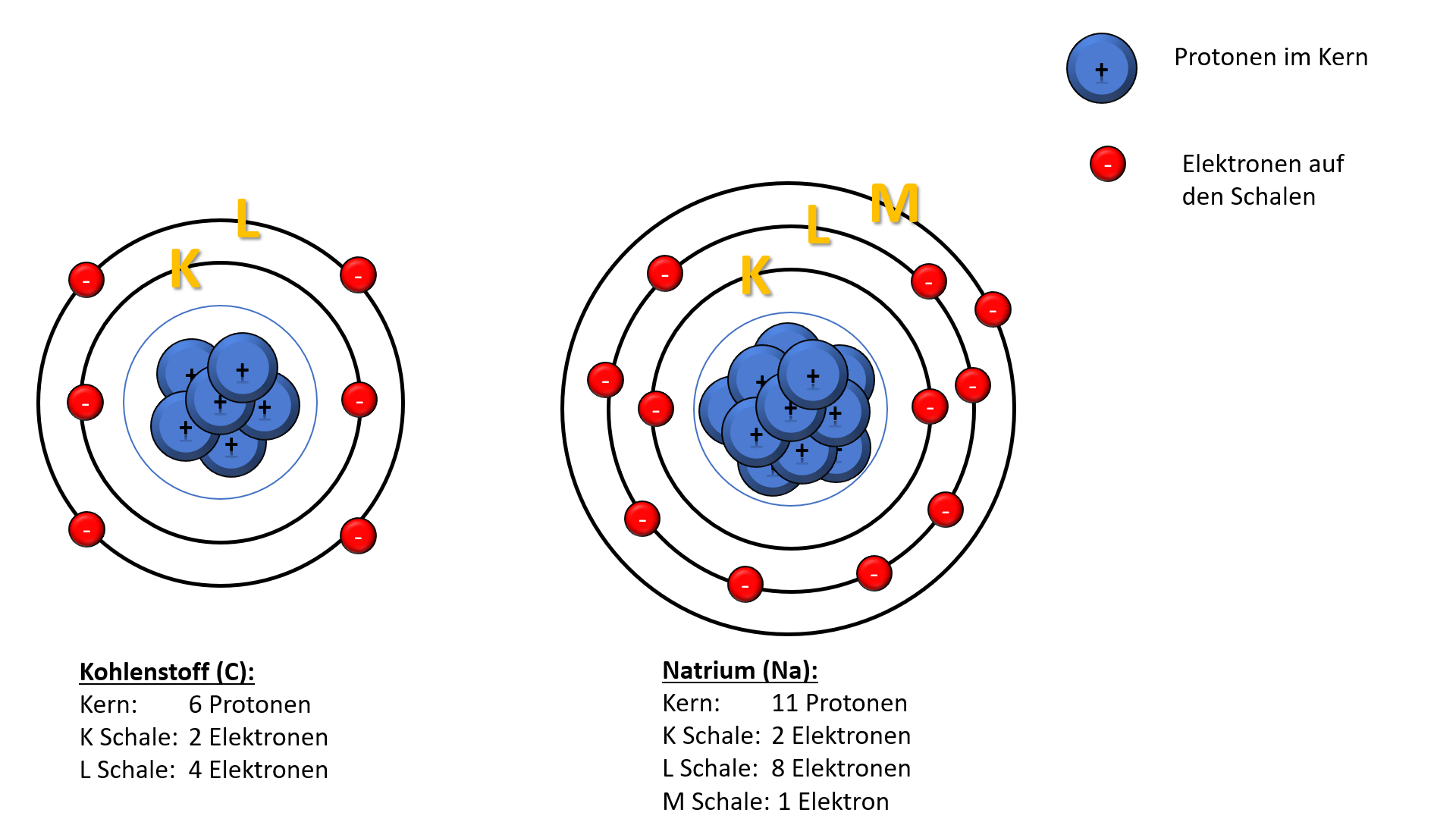
Elektronen befinden sich im Atom in ganz bestimmten Abständen vom Atomkern auf Schalen. Zwischen diesen Schalen liegt ein leerer Raum. Elektronen können und dürfen sich nur auf den Schalen und nicht in den "verbotenen Zonen" aufhalten.
Besetzung der Schalen
Bei der Besetzung der Elektronenbahnen gilt:
Die Anzahl der Elektronen in ungeladenen Atomen beträgt die der Protonen im Kern (Ionen bilden hier eine Ausnahme). Beispiel: Ein Natriumatom hat 11 Protonen und 11 Elektronen.
Prinzip der geringsten Energie: Die erste Bahn wird zuerst besetzt, dann erst die zweite. Beispiel: Kohlenstoff hat 2 Elektronen auf der K-Schale und 4 auf der L-Schale.
Auf der äußersten Schale befinden sich maximal 8 Elektronen (=Oktettregel).
Für die K-, L- und M-Schale gilt: Die maximale Anzahl der Elektronen pro Schale ergeben sich aus der Formel (n= Schalenzahl).
Daraus ergibt sich folgendes Prinzip:
Schale | Schalenzahl | Maximale Elektronenzahl |
|---|---|---|
K-Schale | erste Schale n=1 | 2 |
L-Schale | zweite Schale n=2 | 8 |
M-Schale | dritte Schale n=3 | 18 |
Ab N-Schale | vierte Schale n=4 | 32 |
Quantensprünge
Jede Schale entspricht einem bestimmtem Energieniveau. Je weiter ein Elektron vom Kern entfernt ist, desto energiereicher ist es.
Regt man Atome durch Energiezufuhr an, so springen die Elektronen auf ein höheres Energieniveau (nach Bohr auf eine äußere Schale, über die "verbotene Zone" hinweg).
Beim Rücksprung geben die Elektronen die vorher aufgenommene Energie in Form von Strahlung (wie beispielsweise Licht) wieder ab. Diesen Rücksprung bezeichnet man als Quantensprung.
Je größer die Rücksprungweite, desto energiereicher ist das Licht.
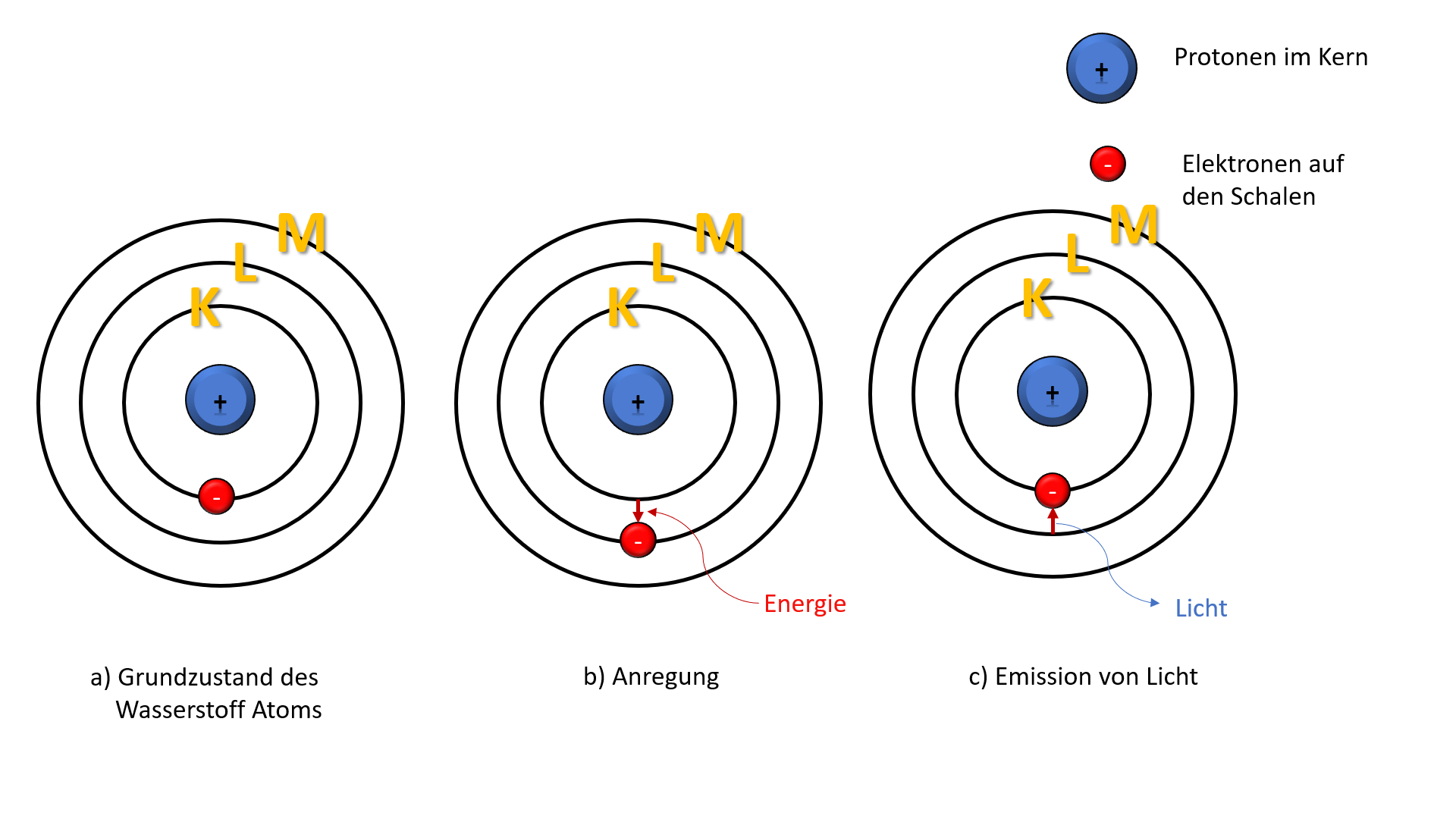
In den 1920er Jahren wurde das Schalenmodell von der Orbitaltheorie abgelöst. Das Schalenmodell lässt sich gut auf Wasserstoffatome anwenden, stößt bei schwereren Atomen allerdings auf seine Grenzen. Obwohl die Elektronen in der Realität nicht auf definierten Bahnen um den Atomkern kreisen, wird das Schalenmodell dennoch oft für Erklärungen herangezogen.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
