Durch die Systematik der Anordnung der Elemente im Periodensystem ist es oft nicht nötig, die Eigenschaften der Elemente einzeln auswendig zu lernen. Viele wichtige Eigenschaften lassen sich direkt aus seiner Stellung im Periodensystem ableiten.
Atomradien
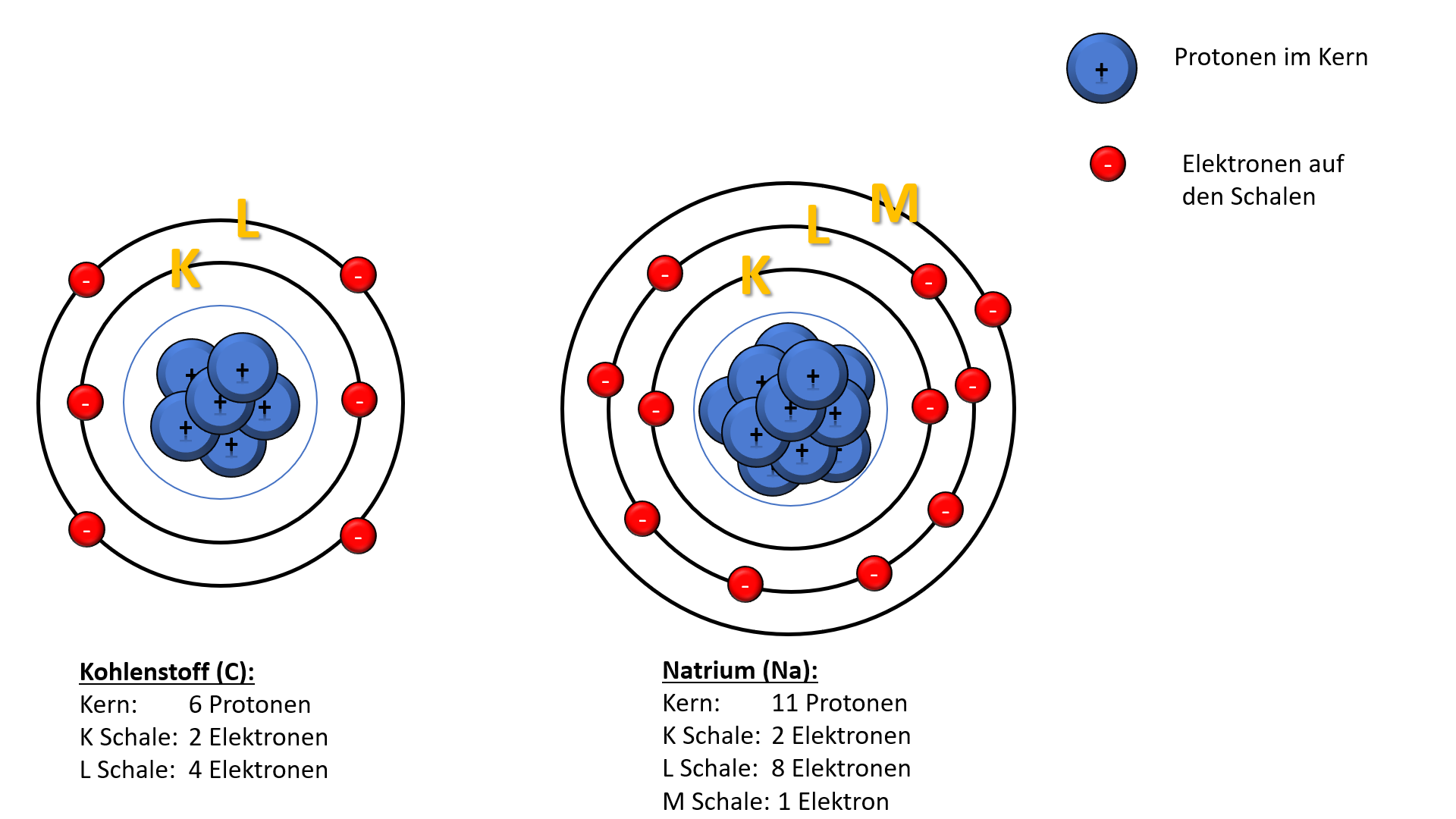
Der Atomradius steigt innerhalb einer Gruppe, da in jeder hinzukommenden Periode eine neue Schale mit Elektronen besetzt wird.
Er nimmt innerhalb einer Periode ab, da mit jedem weiteren Element Protonen im Kern hinzukommen und damit die Kernladung steigt. Durch die zunehmend positive Ladung im Kern werden die Elektronen näher an den Kern gezogen und ihr Aufenthaltsbereich wird kleiner. Somit nimmt der Atomradius ab.
An diesem Beispiel kannst du erkennen, dass das Natriumatom größer ist, als das Kohlenstoffatom. Natrium steht im Periodensystem drei Hauptgruppen weiter links und eine Periode weiter unten als Kohlenstoff.

Ionisierungsenergie
Die Ionisierungsenergie (Energie die aufgewendet werden muss, um Elektronen aus einem Atom zu entfernen) nimmt innerhalb einer Gruppe ab, da die Kernladung durch die weiter innen liegenden Elektronen zunehmend abgeschirmt wird und Elektronen auf äußeren Schalen leichter entfernt werden können.
Innerhalb der Perioden erfolgt ein Anstieg der Ionisierungsenergie, da Atome mit gefüllten Schalen eine höhere Stabilität aufweisen.
Schau dir beispielsweise die Elemente Natrium und Chlor an. Die beiden stehen in derselben Periode, aber in unterschiedlichen Gruppen. Zum Erreichen des Edelgaszustandes fehlt dem Chlor nur noch ein Elektron, weswegen sehr viel Energie aufgewendet werden muss, um ein zusätzliches Elektron zu entfernen. Das Natriumatom hat allerdings ein Elektron zu viel für die Edelgaskonfiguration. Deswegen muss kaum Energie aufgewendet werden, um dieses Elektron zu entfernen.

Elektronenaffinität
Bei der Aufnahme von Elektronen (=Elektronenaffinität) wird innerhalb einer Periode mehr Energie frei, da die Elemente sich dem stabilen Zustand der Edelgaskonfiguration nähern.
Innerhalb einer Gruppe nimmt die frei werdende Energie ab, da das zuzufügende Elektron zwar vom Kern angezogen wird, aber zugleich von den vermehrten Elektronen auf den äußeren Schalen abgestoßen wird.
Auch hier kann das Beispiel Natrium und Chlor hilfreich sein. Umgekehrt als in dem Beispiel oben, wird nun sehr viel Energie frei, wenn das Chloratom ein zusätzliches Elektron aufnimmt und den stabilen Edelgaszustand erreicht. Natrium hingegen erreicht durch die Aufnahme von einem Elektron keinen stabileren Zustand. Deswegen wird in diesem Fall weniger Energie frei.

Elektronegativität
Im Periodensystem nimmt die Elektronegativität mit steigender Ordnungszahl in den Hauptgruppen ab und in den Perioden zu. Sie ist damit umgekehrt proportional zur Atomgröße: Je weiter der positive Atomkern entfernt, umso weniger gut kann die negative Ladung (das Elektronenpaar) zu Atom hingezogen werden.
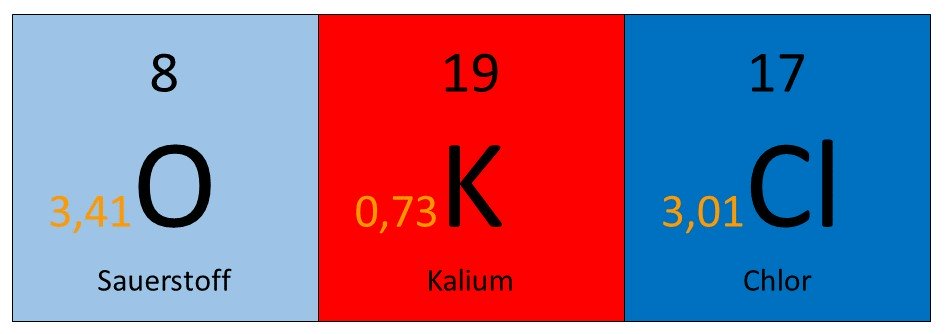
In dem Beispiel unten ist die Elektronegativität links neben dem Elementsymbol angegeben.
Kalium hat die geringste Elektronegativität. Es steht auch weiter links und weiter unten im Periodensystem, als Sauerstoff und Chlor.
Sauerstoff ist zwar eine Gruppe links, aber auch eine Periode über Chlor. Deswegen hat Sauerstoff auch eine höhere Elektronegativität als Chlor.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
