Das Orbitalmodell (oder auch wellenmechanisches Atommodell) beschreibt "Räume", in denen sich die Elektronen mit 90 %iger Wahrscheinlichkeit aufhalten.
Elektronen können sich je nach Versuchsbedingungen wie Teilchen, aber auch gleichzeitig wie Wellen verhalten (Welle-Teilchen Dualismus). Im Orbitalmodell werden die Elektronen als stehende Wellen aufgefasst.
In den 1920er Jahren löste dieses Modell das Bohr´sche Schalenmodell ab.
Form der Orbitale
Nach einer mathematischen Gleichung von dem österreichischen Physiker Erwin Schrödinger ergeben sich die Formen der Orbitale.
Das eine s-Orbital
Von englisch sharp (begrenzt)
Kugelförmig
Für 2 Elektronen
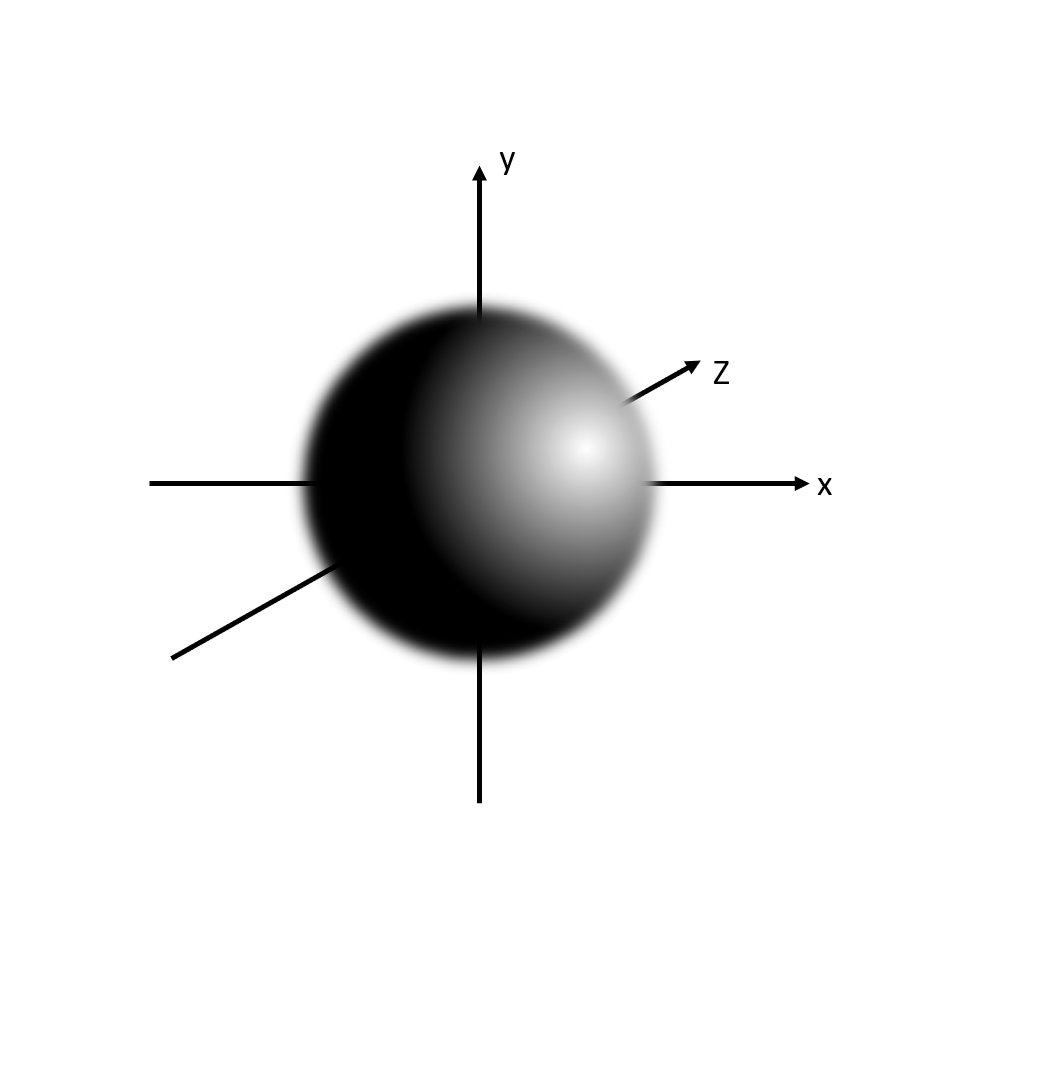
Die drei p-Orbitale
Von englisch pricipal (hauptsächlich)
Keulenförmig
Für maximal 6 Elektronen (pro Orbital 2 Elektronen)
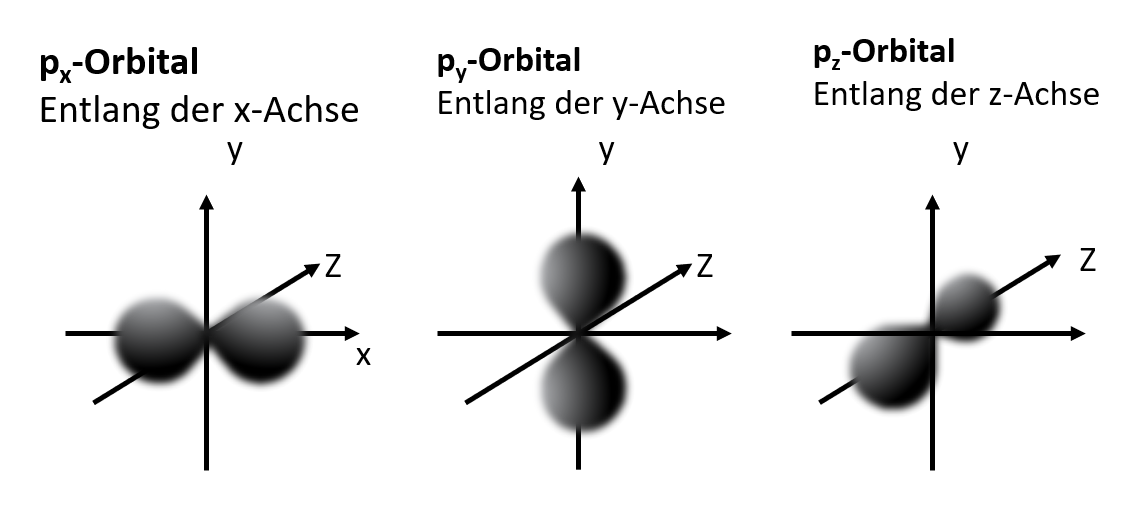
Die fünf d-Orbitale
Von englisch diffuse (zerstreut)
Gekreuzte Doppelhantel
Für maximal 10 Elektronen (pro Orbital 2 Elektronen)
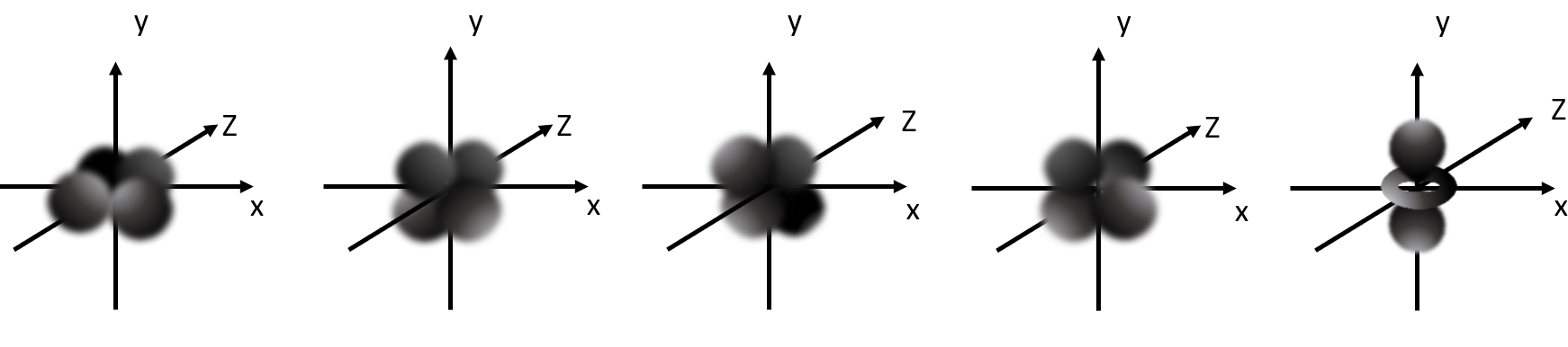
Die sieben f- Orbitale
Von englisch fundamental (grundlegend)
Rosettenförmig
Für maximal 14 Elektronen (pro Orbital 2 Elektronen)
Die Besetzung der Orbitale mit Elektronen erfolgt nach bestimmten Regeln, welche du in dem Artikel "Elektronenbesetzung im Orbitalmodell" nachlesen kannst.
Auch können die einzelnen Elektronen durch sogenannte Quantenzahlen beschrieben werden. Durch diese kannst du erfahren, in welchem Orbital sich ein bestimmtes Elektron befindet. Ausführliche Informationen dazu erhältst du in dem Artikel "Orbitale und ihre Quantenzahlen".
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
