1 Übersicht
Inhalt des Kurses
Dieser Kurs behandelt alles Rund um das Thema Alkohol. Der Inhalt ist stark an den Lehrplaninhalten der 10. Klasse Gymnasium Bayern orientiert (Lehrplan 10. Klasse Chemie NTG), weshalb er sich an fortgeschrittene Schüler richtet.
Inhalte:
Methanol und Ethanol - Beispiele für Alkohole
Homologe Reihe und Nomenklatur der Alkohole
Stoffeigenschaften:
Siedetemperatur
Löslichkeit
Oxidierbarkeit von Alkanolen
Alkohol als Sucht- und Genussmittel
Vorkenntnisse
Grundwissen der Jahrgangsstufen 8 + 9 (naturwissenschaftlicher Zweig)
Grundkenntnisse in der organischen Chemie: Alkane, Alkene und Alkine
Wertigkeit
Zwischenmolekulare Kräfte
Redoxreaktionen
Kursdauer
Dieser Kurs dauert ca. 1,5 Stunden.
2 Einführung
Jugendliche öfter mit Alkoholvergiftung im Krankenhaus
<< Erfurt (dpa/th) - Häufiger als früher landen Kinder und Jugendliche mit Alkoholvergiftung in Thüringens Krankenhäusern. Insgesamt 620 Patienten im Alter von 10 bis 19 Jahren wurden im vergangenen Jahr wegen eines gefährlichen Alkoholrausches in den Kliniken behandelt. Das seien 17 Prozent mehr als noch ein Jahr zuvor, wie die Krankenkasse DAK Gesundheit mit Verweis auf Zahlen des Thüringer Landesamtes für Statistik am Dienstag mitteilte. Nach den amtlichen Angaben gab es seit Jahren nicht so viele Fälle jugendlicher Komasäufer wie 2017.Aufklärung sei daher weiter nötig, sagt Marcus Kaiser, Leiter der Landesvertretung der DAK-Gesundheit in Thüringen. Entsprechend plane die Krankenkasse im kommenden unter der Schirmherrschaft von Thüringens Gesundheitsministerin Heike Werner (Linke) wieder die Kampagne "bunt statt blau", um damit im Schulalltag über die Folgen von Alkoholkonsum zu informieren. >>
Quelle: Süddeutsche Zeitung, 20. November 2018, Jugendliche öfter mit Alkoholvergiftung im Krankenhaus [zuletzt aufgerufen: 29.12.18, 15:00 Uhr]
Alkohole
Der wohl bekannteste Alkohol ist der Trinkalkohol – oder auch Ethanol genannt. Viele Jugendliche kommen gerade in der 10. Klasse in das Alter, wo sie das erste mal legal Alkohol konsumieren dürfen (zum Beispiel Bier). Jedoch sind sie sich oft nicht bewusst, was der Alkohol für Auswirkungen auf den Körper hat, was der oben genannte Artikel nur bestätigt. Der Trinkalkohol ist ein auch natürlich vorkommendes Produkt der alkoholischen Gärung von Früchten, wie zum Beispiel Trauben. Dieses Phänomen wurde schon ca. 10.000 v. Chr. zufällig entdeckt, wodurch der Trinkalkohol bis heute als Genussmittel, Lösemittel, Geruchsträger, Kraftstoff und Desinfektionsmittel gebraucht wird.Ethanol ist jedoch nur eines von vielen Beispielen aus der chemischen Stoffklasse der Alkohole, welche auch von großer Bedeutung für die Industrie sind (z.B. Lackindustrie).

Abbildung 1: Alkoholflaschen in einer Bar (Quelle: Pixabay)
3 Methanol
Allgemeines
Immer wieder liest man in Nachrichtenportalen von schweren, oft sogar tödlich verlaufenden Vergiftungen, die durch selbstgebrauten Schnaps zustande kommen. Verantwortlich für die Vergiftungen ist dabei das im Vergleich zu Ethanol wesentlich giftigere Methanol, das durch Holzdestillation entsteht und nur schwer vom Ethanol abgetrennt werden kann. Da Methanol deutlich billiger als Ethanol und geschmacklich identisch mit diesem ist, wird es oft von rücksichtslosen “Panschern” beigemischt.
Giftigkeit
Im Körper wird Methanol durch die sogenannte Alkoholdehydrogenase zu Formaldehyd oxidiert, das einerseits leicht Proteine, wie z.B. Netzhautproteine verändert (denaturiert), was zur Erblindung führen kann und andererseits weiter zu Ameisensäure metabolisiert wird, die leicht zu einer Azidose (Übersäuerung) führt. Als letale Dosis gelten ca. 0,1g pro kg Körpergewicht.
Darstellung
Wie der Trivialname Holzgeist schon andeutet, wurde Methanol früher durch Destillation von Holz gewonnen, wobei im Destillat ca. 1,5 - 3 Prozent enthalten waren. Heute wird es industriell aus einem Synthesegasgemisch, das aus Erdöl gewonnen wird, gewonnen. Dabei werden Kohlenstoffmonoxid und Wasserstoff bei circa 200 bar und 400 Grad Celsius mithilfe eines Katalysators (ein Teilchen, das die Reaktion beschleunigt) wie z.B. Zinkoxid/Chrom(II)oxid zu Methanol umgesetzt:
Eine weitere Möglichkeit besteht darin, die im Pektin der Pflanzenzellwand enthaltenen Methylester durch Hydrolyse unter Carbonsäureabspaltung in Methanol umzuwandeln. Auch die Umwandlung von Biomasse (zum Beispiel Tiermehl aus Schlachtabfällen) in Synthesegas, aus welchem wiederum Methanol erzeugt werden kann, ist möglich. Hier können aus 1t Tiermehl ca. 1t Methanol gewonnen werden.
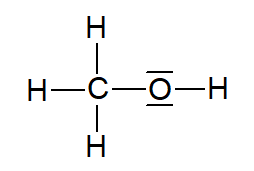
Abbildung 2: Struktuformel Methanol (Quelle: erstellt mit ChemSketch)
Bedeutung und Verwendung
Methanol ist der industriell bedeutendste Alkohol. Im Jahr 2012 wurden weltweit über 60 Millionen Tonnen produziert. Es dient nicht nur als Syntheserohstoff zur Herstellung von Methanal, (Diethyl)ether, Essigsäure und Aminen, sondern auch als Lösemittel für Lacke. Aufgrund seiner hohen Octanzahl wird es auch Treibstoffen zugesetzt,um deren Klopffestigkeit zu erhöhen. Durch Veresterung mit Rapsöl entsteht außerdem Biodiesel. Selbst in der Raumfahrt findet der Stoff in speziellen Brennstoffzellen Anwendung.
4 Ethanol - der Trinkalkohol
Geschichte des Trinkalkohols (Ethanol)
Der Alkohol (aus dem Arabischen “alkuhul” = “etwas Feines”) ist die älteste Droge der Welt und wurde vermutlich ca. 10.000 v. Chr. in der Mittelsteinzeit ganz zufällig bei der Gärung von überreifen Früchten entdeckt. Die ersten eindeutigen Quellen stammen aus Ägypten (3.000 v. Chr.), in denen der Bierbrauprozess erläutert wurde. Es liegen aber auch Hieroglyphen vor, die die Nebenwirkungen des Alkohols darstellen (Erbrechen und Abtransport von Betrunkenen). Der Alkoholgehalt des Bieres war bei den Ägyptern, aber auch Römern, im Vergleich zu heute deutlich geringer. Die Römer tranken vorwiegend Wein und benutzen Bier nur um ihren erhitzten Kopf zu kühlen. Dadurch dass Alkohol zunächst nur durch die alkoholische Gärung an bestimmten Jahreszeiten hergestellt wurde, und somit nicht allzu lange haltbar war, gab es damals sehr wenig Alkoholprobleme, da, wenn alles aufgebraucht wurde, es längere Zeit keinen Alkohol mehr gab.
Eigenschaften
Ethanol ist eine
würzig riechende,
brennend schmeckende,
farblose, klare,
leichtentzündliche,
hygroskopische (wasserbindende)
Flüssigkeit.
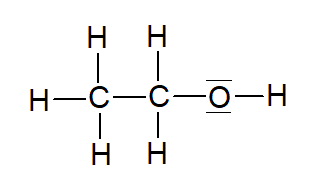
Abbildung 3: Strukturformel Ethanol (Quelle: erstellt mit ChemSketch)
Herstellung
Natürliche Herstellung (alkoholische Gärung)
Jeder, der schon mal seinen Apfel- oder Traubensaft längere Zeit stehen gelassen hat, wird einen charakteristischen Geruch wahrgenommen haben. Dieser wird durch den aus der alkoholischen Gärung entstanden Ethanol verursacht. Nationale Gesetze legen fest, dass der Ethanol, der für alkoholische Getränke benötigt wird, nur über die alkoholische Gärung (natürlicher Weg) produziert werden darf.
Bei der alkoholischen Gärung werden unter anaeroben Bedingungen (Sauerstoffmangel) hauptsächlich Einfachzucker wie Glucose und Fructose von Enzymen aus Hefepilze zu Ethanol und Kohlenstoffdioxid abgebaut.

Abbildung 4: Sudkessel einer Brauerei für die alkoholische Gärung (Quelle: Pixabay)
Künstliche/Industrielle Herstellung:
Um die riesige Menge an Ethanol, die von der Industrie benötigt werden, zu produzieren, verwendet man eine technische Methode, die im Vergleich zum Gärungsprozess, deutlich schneller ist. Dazu sind sowohl hohe Temperaturen, ein hoher Druck sowie Phosphorsäure als Katalysator notwendig:
Verwendung
Genussmittel
in Medizin und und Pharmazie: Extraktionsmittel, Tinkturen und Desinfektionsmittel
Thermometer: Ersatz für früher verwendetes giftiges Quecksilber
Lösemittel (z.B. für Farben- und Lackindustrie)
Bioethanol (PKW-Kraftstoffe)
Reinigungsmittel (in Form von Brennspiritus)
5 Unterscheidung von Methanol und Ethanol (Flammenfärbung)
Versuch:
Um die beiden sehr ähnlich aussehenden Flüssigkeiten Methanol und Ethanol unterscheiden zu können, bedient man sich im Labor dem Versuch der Flammenfärbung (Lehrerversuch).
Dauer: ca. 10 min
Materialien:
2 Porzellanschalen
1 Glasstab
1 Spatel
1 Messzylinder
1 Feuerzeug
Methanol (Sicherheitsdatenblatt)
Ethanol (Sicherheitsdatenblatt)
Borsäure (Sicherheitsdatenblatt)
Versuchsbeschreibung
In ein Becherglas werden etwa 10 ml Methanol, in ein zweites etwa 10 ml Ethanol gegeben.
Zu beiden Flüssigkeiten werden jeweils 2-3 Spatelspitzen Borsäure hinzugegeben.
Die beiden Proben werden nun mit einem Glasstab durchgerührt.
Zum Schluss entzündet man beide Proben mit einem Feuerzeug.
Beobachtung

Abbildung 5: Flammenfärbung: Methanol (grüne Flamme) und Ethanol (blaue Flamme) (Quelle: YouTube)
Erklärung
Methanol lässt sich mit Borsäure zu Borsäuretrimethylester verestern (Veresterung).Bei der Verbrennung dieses Gemisches entsteht eine grüne Flamme.
Ethanol dagegen kann nur in schwefelsaurer Lösung mit Borsäure verestert werden. Somit verbrennt Ethanol hier nicht mit grüner, sondern mit einer blau-lilanen Flamme.Auf diese Art können Methanol und Ethanol anhand der unterschiedlichen Flammenfarben auseinandergehalten werden.
Video: Flammenfärbung
Laden
6 Übungsaufgaben zu Methanol und Ethanol
Laden
Laden
Laden
Laden
7 Nomenklatur der Alkohole
Nach der Erlenmeyer-Regel ist an einem Kohlenstoffatom maximal eine Hydroxygruppe gebunden. An welchem Kohlenstoffatom die Hydroxy-Gruppe gebunden ist, gibt die Ziffer vor der Endung “-ol” an. Die Kohlenstoffatome der längsten Kohlenstoffkette werden so nummeriert, dass die endständige Hydroxy-Gruppe der kleinstmöglichsten Zahl zugeordnet wird.
Beispiele:
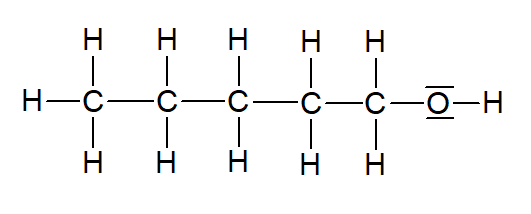
Abbildung 6: Pentan-1-ol (erstellt mit ChemSketch)
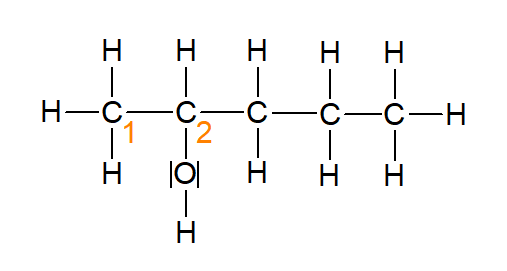
Abbildung 7: Pentan-2-ol (erstellt mit ChemSketch)
Unter den Alkanolen unterscheidet man noch zusätzlich, ob es sich bei dem jeweiligen Molekül um einen primären (a), sekundären (b) oder tertiären (c) Alkohol handelt. Dies hängt davon ab, wie viele Kohlenstoffatome noch an dem Kohlenstoffatom, an dem die Hydroxygruppe gebunden ist, hängen.
In der Abbildung 8 (Pentan-2-ol) handelt es sich um ein sekundären Alkohol. Die benachbarten Kohlenstoffatome sind mit A und B gekennzeichnet.
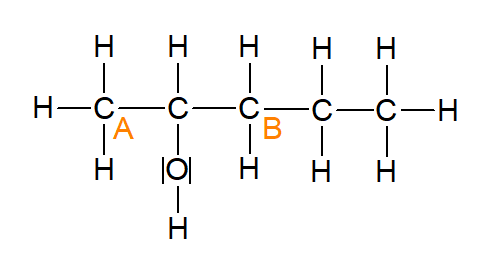
Abbildung 8: Pentan-2-ol (erstellt mit ChemSketch)
In der Abbildung 9 (2-Methylpentan-2-ol) handelt es sich, dadurch, dass durch die Methyl-Gruppe noch ein Kohlenstoffatom hinzukommt, um einen tertiären Alkohol.
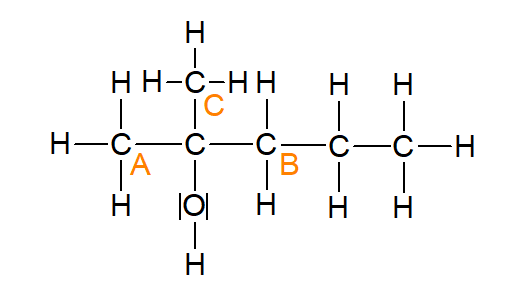
Abbildung 9: 2-Methylpentan-2-ol (erstellt mit ChemSketch)
Man spricht von einem mehrwertigen Alkohol, sobald in einem Molekül mehrere Hydroxygruppen vorliegen. Die Lage der OH-Gruppen wird nach dem Namen der längsten Kohlenstoffkette mit den entsprechenden Ziffern gekennzeichnet. Vor der Endung “-ol” wird je nach Anzahl der Hydroxygruppen noch die griechische Zahl dazu eingefügt (mono, di, tri, usw.).
Da das Alkoholmolekül in der Abbildung 10 drei Hydroxygruppen besitzt, nennt man es dreiwertig.
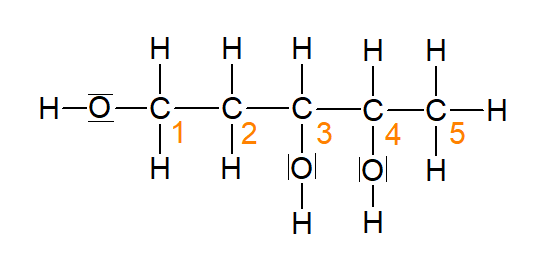
Abbildung 10: Pentan-1,3,4-triol (erstellt mit ChemSketch)
8 Die homologe Reihe der Alkanole
Analog zu den Alkanen, gibt es auch bei den Alkoholen eine Reihe von Verbindungen, die sich in ihrem Aufbau nur durch den Zusatz von jeweils einer -Gruppe unterscheidet.
Die homologe Reihe der einwertigen, primären Alkanole:
Allgemeine Formel der einwertigen primären Alkanole:
Funktionelle Gruppe: Hydroxy-/-OH-Gruppe
Systematischer Name | Molekülformel | Strukturformel |
|---|---|---|
Methanol | 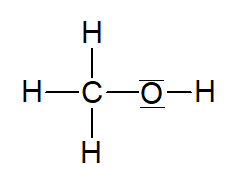 | |
Ethanol | 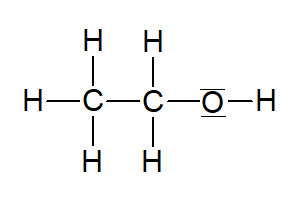 | |
Propan-1-ol | 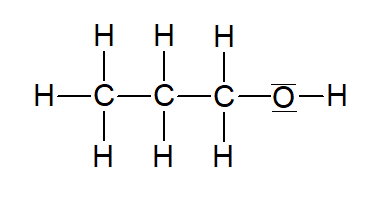 | |
Butan-1-ol | 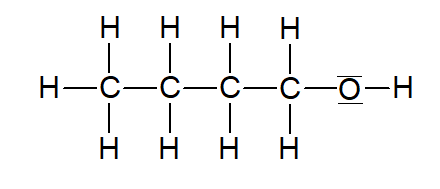 | |
Pentan-1-ol | 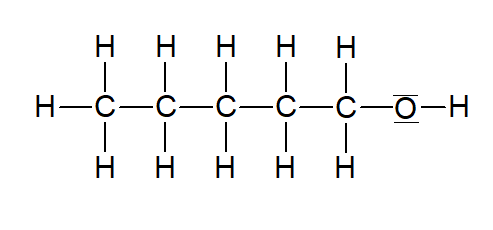 | |
Hexan-1-ol | 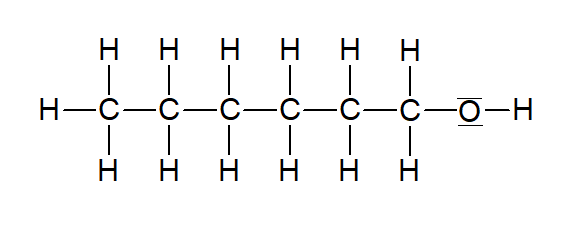 | |
... | ... | ... |
Tabelle 1: Homologe Reihe der primären Alkanole (ersetellt mit ChemSketch)
9 Übungsaufgaben zur Nomenklatur und homologen Reihe der Alkohole
Laden
Laden
Laden
10 Stoffeigenschaften der Alkanole
Siedetemperatur
Vergleicht man die Siedetemperaturen der Alkane mit denen der Alkanole, so fällt auf, dass die Siedetemperaturen der Alkanole mit vergleichbarer Molarer Masse deutlich höher liegen als bei den Alkanen (siehe Abbildung 11).
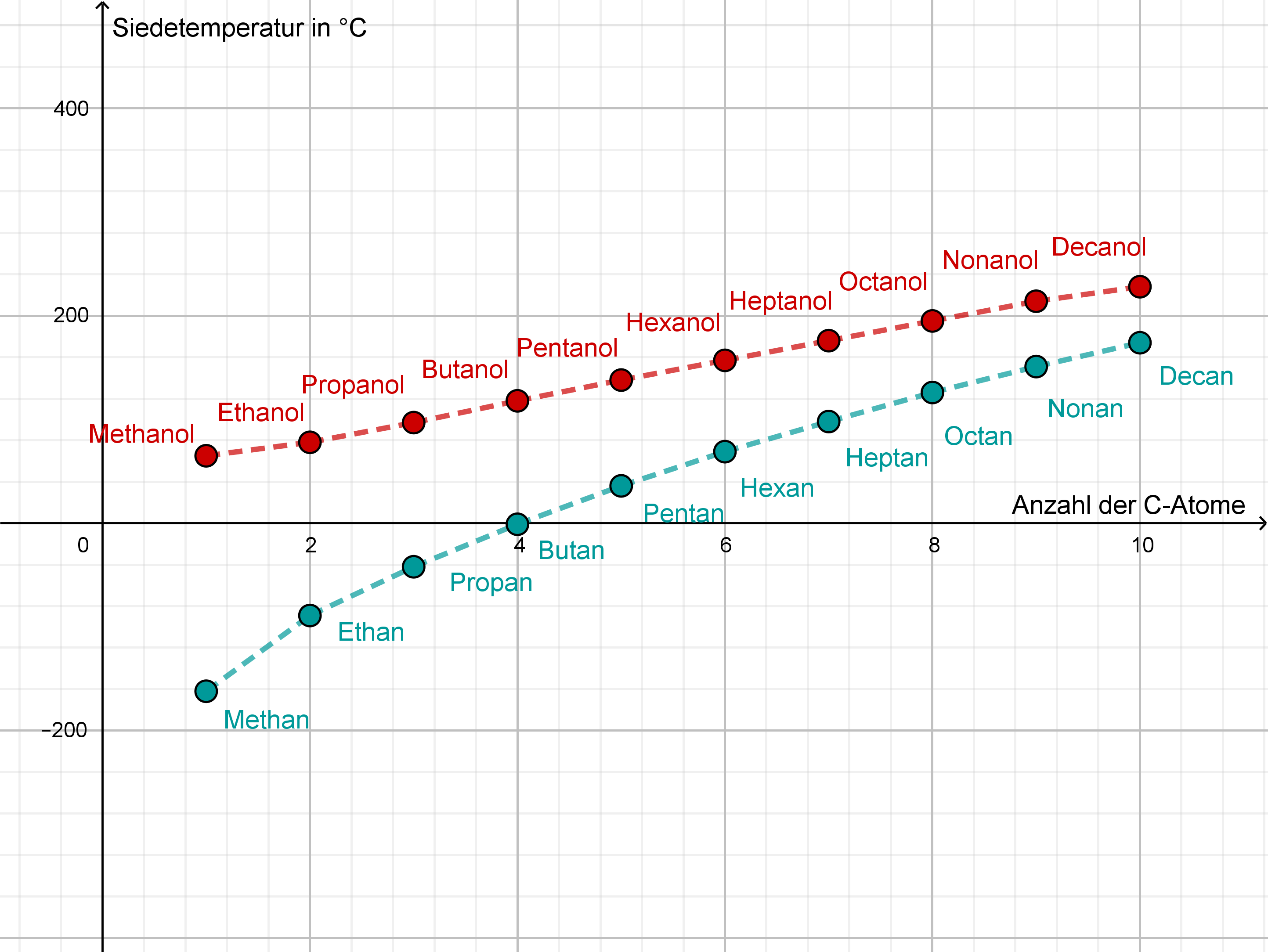
Abbildung 11: Siedetemperaturen der Alkane und Alkanole (erstellt mit GeoGebra)
Warum ist das so?
Um diese Frage zu beantworten muss die Hydroxy-Gruppe der Alkanole genau unter die Lupe genommen werden:Dadurch dass das Sauerstoffatom eine Elektronegativität von 3,5 und das Wasserstoffatom eine von 2,1 hat, ist die Elektronegativitätsdifferenz vergleichsweise sehr hoch (ΔEN=1,4). Somit zieht das Sauerstoffatom aufgrund seiner hohen Elektronegativität das bindende Elektronenpaar zu sich heran, sodass es zu einer Ladungsverschiebung kommt. Durch diese Ladungsverschiebung ist die Hydroxygruppe stark polar (polare Bindung), da das Sauerstoffatom eine negative Teilladung und das Wasserstoffatom dementsprechend eine positive Teilladung erhält (siehe Abbildung 12).
Der Alkylrest im Molekül hingegen ist unpolar, da die Elektronegativitätsdifferenz des Kohlenstoffatoms und Wasserstoffatoms - aufgrund der sehr ähnlichen Elektronegativität - fast null ist.
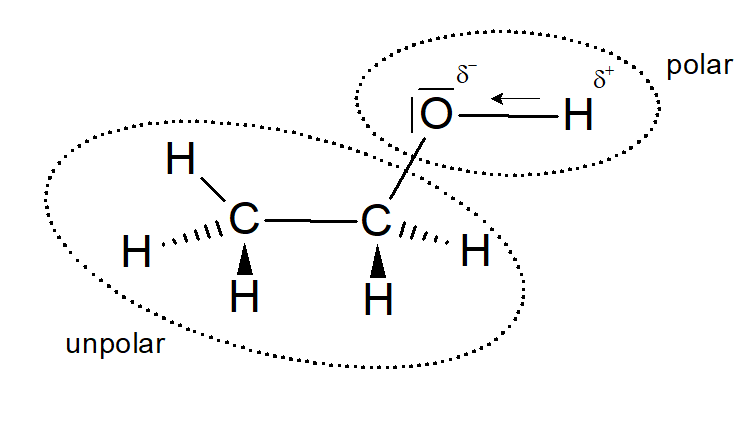
Abbildung 12: Polarität des Ethanols (erstellt mit ChemSketch)
Dadurch dass sich die negativen Sauerstoffatom mit den positiven Wasserstoffatomen anziehen, kommt es an den OH-Gruppen der Alkanole zu starken zwischenmolekularen Kräften - den Wasserstoffbrücken (siehe Abbildung 13).
Somit herrschen zwischen den Alkanol-Molekülen nicht nur die Van-Der-Waals Kräfte (wie es bei den Alkanol-Molekülen der Fall ist), sondern es liegen zusätzlich noch Wasserstoffbrückenbindungen vor. Das heißt, dass beim Sieden der Alkanole diese zusätzlichen zwischenmolekularen Kräften überwunden werden müssen, was die vergleichsweise hohe Siedetemperatur erklärt (vgl. Abb. 13).
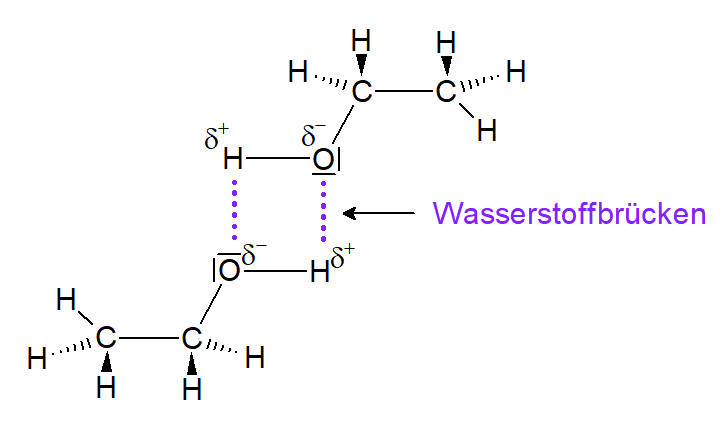
Abbildung 13: Wasserstoffbrücken zwischen Ethanolmolekülen (erstellt mit ChemSketch)
Löslichkeit
Name | Löslichkeit in Wasser (25 °C) | Löslichkeit in Benzin |
|---|---|---|
Methanol | beliebig löslich | unlöslich |
Ethanol | beliebig löslich | löslich |
Propan-1-ol | beliebig löslich | löslich |
Butan-1-ol | löslich | |
Pentan-1-ol | löslich | |
Hexan-1-ol | löslich | |
Hexadecan-1-ol | unlöslich | löslich |
Tabelle 2: Löslichkeit der Alkanole in Wasser und Benzin
(Alkane sind in Benzin alle löslich, in Wasser jedoch nicht löslich.)
Vergleicht man die Löslichkeit der Alkohole mit denen der Alkane, so fallenzwei Sachverhalte auf:
Mit Zunehmender Länge der Kohlenstoffkette der Alkoholmolekülenimmt die Löslichkeit der Alkohole in Wasser immer weiter ab.
Im Gegensatz zu den Alkanen sind (kurzkettige) Alkohole in Wasserlöslich.
Woran liegt das?
Schauen wir uns einmal den Aufbau eines Alkoholmolekülsnoch einmal genauer am Beispiel des Ethanols und des Decanols an:
Ein Alkoholmolekül besitzt immer mindestens eine Hydroxy-Gruppe(-OH-Gruppe)Diese zeichnet sich durch eine hohe Elektronegativitätsdifferenz der beiden Atome von 1,4 aus, was bedeutet, dass diese funktionelle Gruppe polar ist. Wir wissen, dass Wassermoleküle ebenfalls polar sind und schlussfolgern aus dem Merksatz "Ähnliches löst sich in Ähnlichem", dass sich Alkohole in Wasser und anderen polaren Stoffen lösen lassen.
Warum aber gilt das nicht für längerkettige Alkohole wie etwa Decanol?
Im Vergleich zu Ethanol besitzt Decanol eine deutlich längere Kohlenstoffkette. Die C-H-Bindungen dieser weisen eine geringe Elektronegativitätsdifferenz der Atome von nur 0,4 auf, was bedeutet dass dieses Molekülteil unpolar ist. Er wird allgemein als unpolarer Rest bezeichnet. Je länger jetzt also dieser unpolare Rest ist, desto mehr bestimmt er die physikalischen Eigenschaften des Moleküls und senkt somit dessen Polarität, was die Abnahme der Wasserlöslichkeit mit zunehmender Länge der Kohlenstoffkette bei Alkoholen erklärt.
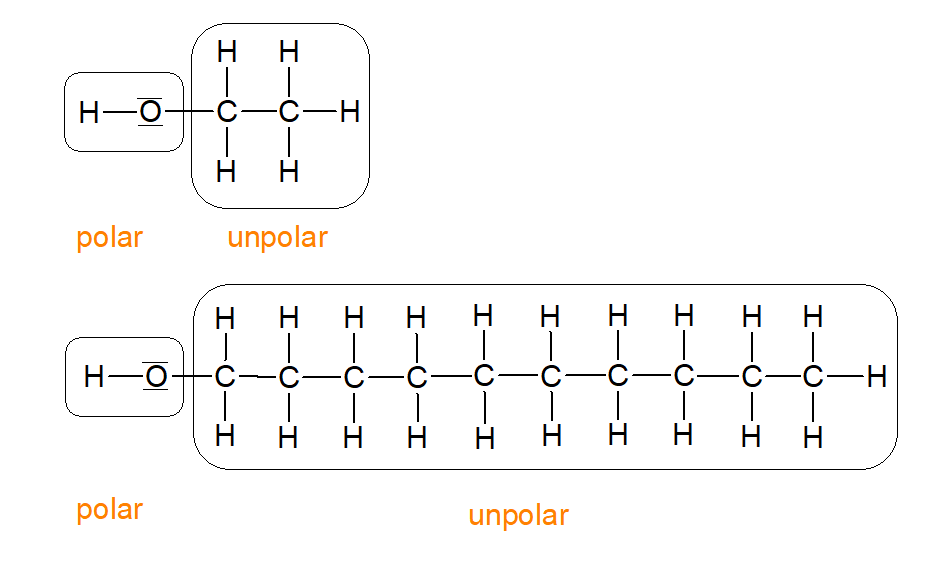
Abbildung 14: Vergleich von Ethanol und Decanol (erstellt mit ChemSketch)
11 Übungsaufgaben zu Stoffeigenschaften der Alkanole
Laden
Laden
Laden
Laden
12 Oxidation von Alkoholen durch Permanganatlösung
Versuch (Schülerversuch):
Dauer: 10 min
Benötigte Materialien:
Dreigeteilte Petrischale
3 Tropfpipetten
Messzylinder (mind. 50 ml)
Verdünnte Kaliumpermanganat-Lösung (; c() =0,01 mol/l)
Natronlauge (; c() =1 mol/l)
Propan-1-ol (a)
Propan-2-ol (b)
2-Methylpropan-2-ol (c)
Versuchsbeschreibung:
-Lösung wird mit -Lösung im Verhältnis 2:1 vermischt.
In jede der drei Sektoren der Petrischale werden je 3 ml der Lösung pipettiert.
Es werden zu jedem Sektor 2 ml von einem Alkohol (a, b oder c) hinzugefügt.
Beobachtung:
Sektor (a): violett → gelbbraune Färbung
Sektor (b): violett → grüne Färbung
Sektor (c): violett → keine Farbänderung
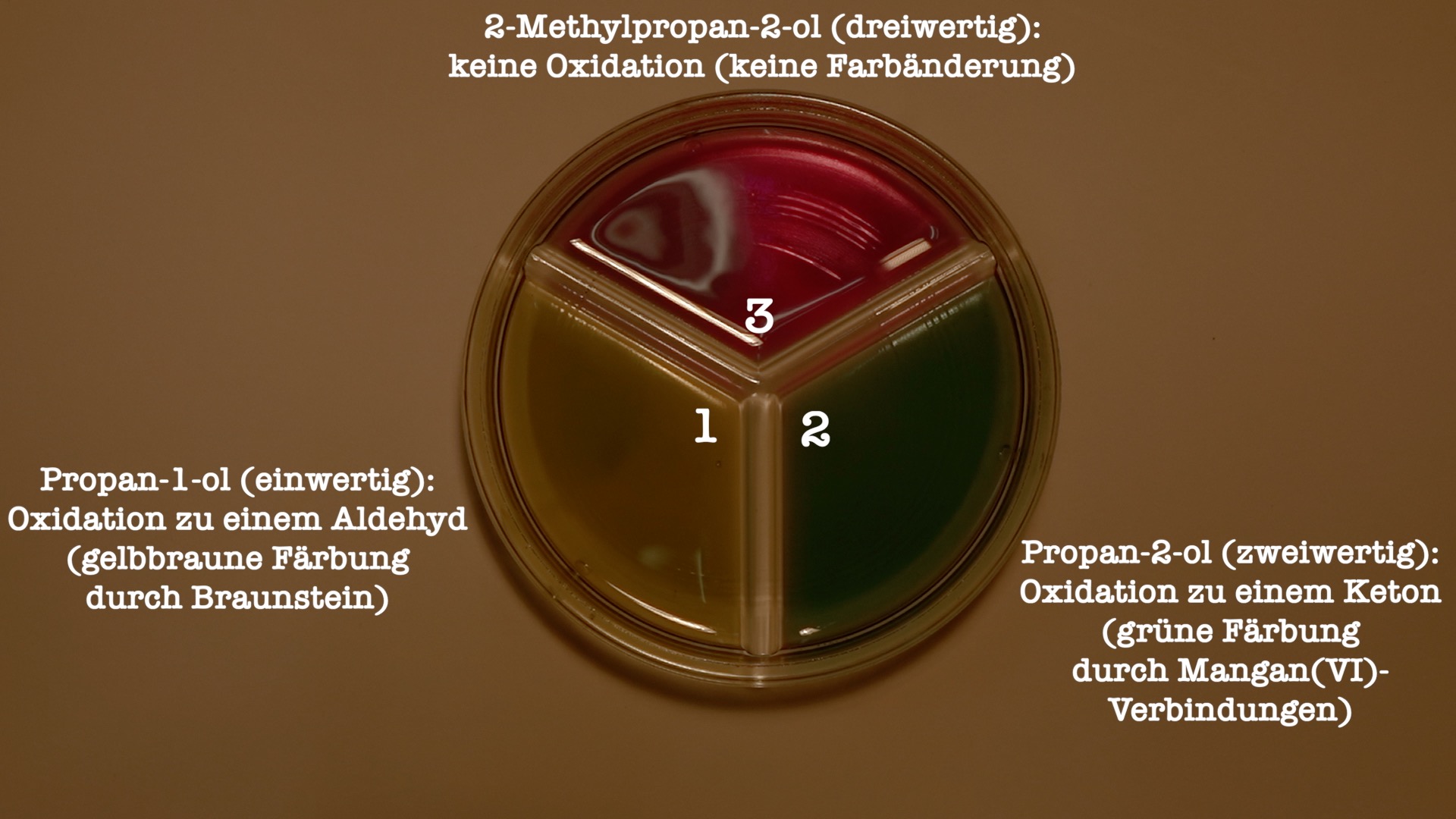
Abbildung 15: Oxidation von Alkoholen durch Permanganatlösung (Quelle: YouTube)
Erklärung:
a) Propan-1-ol: Propan-1-ol ist ein primärer Alkohol, dessen Moleküle Permanganationen () zu Braunstein () reduzieren. Dabei wird der Alkohol zu einem Aldehyd oxidiert (hier: Propanal).
Oxidation:
Reduktion:
Redoxreaktion:
Braunstein ist ein gelbbrauner Farbstoff und für die Farbänderung verantwortlich.
b) Propan-2-ol: Propan-2-ol ist ein sekundärer Alkohol, dessen Moleküle Permanganationen () zu Mangan(VI)-Verbindungen (grün) reduzieren und dabei zu einem Keton (hier: Aceton) oxidiert werden.
Oxidation:
Reduktion:
Redoxreaktion:
c) 2-Methylpropan-2-ol: 2-Methylpropan-2-ol ist ein tertiärer Alkohol, dessen Moleküle nicht oxidiert werden können. Die Farbe verändert sich daher nicht.
Video:
Laden
13 Alkohol als Sucht- und Genussmittel
Weltweit ist der Alkoholkonsum weit verbreitet. Im Jahr 2016 hatten 43% der über 15-Jährigen Alkohol getrunken, in Europa waren es sogar 60%. Durchschnittlich hatte dabei jeder Mensch über 15 Jahren 6,4 Liter reinen Alkohols getrunken, in Europa sogar 9,8 Liter. Das zeigt, dass der Alkohol als Genussmittel vor Allem in Europa sehr beliebt ist. Im Jahr 2018 starben in Deutschland ca. 74.000 Menschen an den Folgen des Alkoholkonsums.
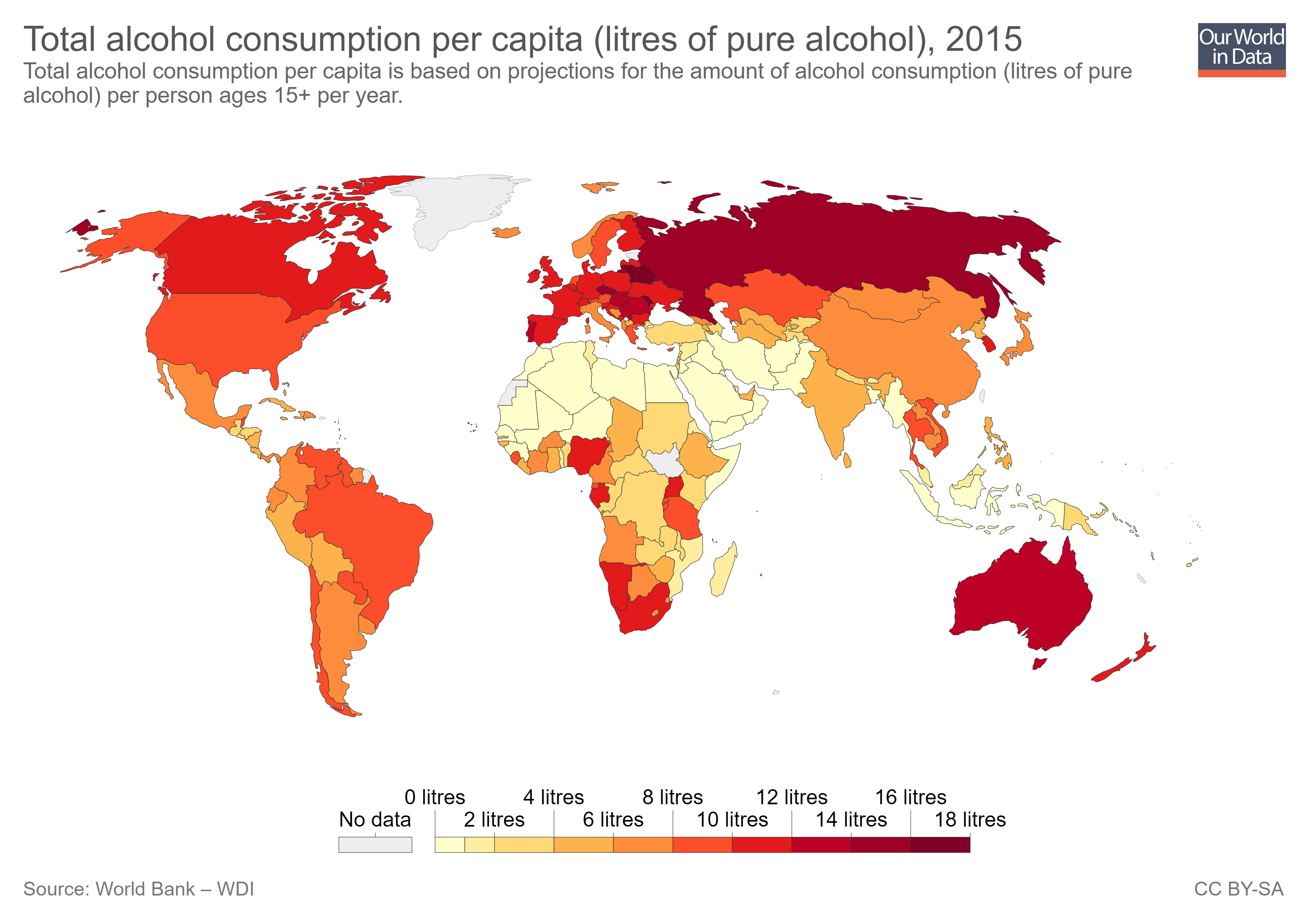
Abbildung 16: Alkoholkonsum der Länder im Jahr 2015; in Liter reinen Alkohols pro Einwohner; Englisch: litres = Liter (Quelle: Our Wolrd in Data)
Wirkungsweise:
Alkohol gelangt neben den Mund- und Magenschleimhäuten vorwiegend über den Dünndarm ins Blut und wirkt auf das zentrale Nervensystem des Gehirns, wobei es die Erregungsübertragung zwischen den Nervenzellen beeinflusst.
Wirkung:
Tritt nach 15-30 Minuten ein, bei vollem Magen kann es bis zu 2 Stunden dauern
Ist abhängig von der aufgenommenen Alkoholmenge, ein Indikator dafür ist die sogenannte Blutalkoholkonzentration (BAK) die in Promille (Tausendstel) angegeben wird
Grobe Berechnung des BAK durch Widmark-Formel:
(m = Körpergewicht; r = Verteilungsfaktor (Frauen: 0,6; Männer: 0,7))
Beispiel: Wie viel Promille hat ein 70kg schwerer Mann nach dem Genuss von 0,5 l Bier das einen Alkoholgehalt von 5% aufweist?
Masse des Alkohols ausrechnen:
(Dichte von Ethanol beträgt 0,8 g/ml)
BAK ausrechnen:
Antwort: Die Person weist 0,41 ‰ Alkohol im Blut auf.
Je nach Toleranz, Art des Trinkens, Mageninhalt usw. kann der Alkoholpegel deutlich schwanken, weshalb die Abschätzung nach der Widmak-Formel nur als grobe Richtlinie dienen sollte
Blutalkoholkonzentration | Wirkungsintensität | Symptome |
|---|---|---|
<0,2 ‰ | sehr leicht | leichte Entspannung und Enthemmung, reden fällt leichter, Stimulation |
0,5-1‰ | leicht | Enthemmung wird stärker, Sprache wird undeutlicher, evtl. leichte Übelkeit, Schwindel, Selbsteinschätzung gestört, leichte Euphorie |
1-2 ‰ | mittel | Orientierungsschwierigkeiten, Schläfrigkeit, eingeschränktes Sichtfeld, Euphorie, starke Enthemmung |
2-3 ‰ | stark | Übelkeit, Erbrechen, starke Benommenheit, Bewegungen eingeschränkt, Gedächtnislücken(“Blackouts”) |
>3 ‰ | sehr stark/ Überdosis--> evtl. Lebensgefahr/tödlich | Bewusstlosigkeit, Atemlähmung, Bewegungs- und Gesprächsfähigkeit sehr stark eingeschränkt |
Quelle: Drogen Wiki
Abbau und Nachwirkungen:
Abbau erfolgt größtenteils über die Leber durch die Alkoholdehydrogenase
Abbaurate schwankt zwischen 0,1 und 0,2 Promille pro Stunde je nach Mageninhalt, Geschlecht, Alter, usw.
Abbauprodukte wie z.B. Ethanal und weitere sogenannte Begleitalkohole der alkoholischen Gärung (=Fuselstoffe, z.B. Butanol, Pentanol, Hexanol) sorgen für “Kater” nach Wirkungsende (Kopfschmerzen, Schwindel, Niedergeschlagenheit)
Wechselwirkungen/Mischkonsum:
Stimulantien (Koffein, Amphetamine, etc.) Unterdrückung der Alkoholwirkung; kann zu gefährlicher Falscheinschätzung des Alkoholpegels und damit zu einer Alkoholvergiftung führen
Beruhigungsmittel (Opioide, Benzodiazepine, etc.) Wirkungsverstärkung; Enthemmung wird verstärkt, Gefahr von Blackouts, Bewusstlosigkeit und Tod durch Atemlähmung steigt
Leberschädigende Medikamente (z.B. Paracetamol) Leberschäden, Leberversagen und Tod ist möglich
Nikotin erhöhtes Krebsrisiko, Blutdruck steigt, Kater wird stärker
Generell ist von Mischkonsum auch mit anderen Stoffen als die oben angeführten, dringend abzuraten! Auch mit anderen Stoffen können lebensbedrohliche Wechselwirkungen auftreten!
Abhängigkeit:
Regelmäßiger Alkoholkonsum kann sowohl zu einer psychischen wie auch zu einer körperlichen Abhängigkeit führen.
Symptome der Abhängigkeit:
starkes Verlangen nach Alkohol (mgl.: Craving), Kontrollverlust über Konsum
Gedächtnislücken
berufliche Leistung lässt nach (aufgrund von Alkohol)
soziale Beziehungen werden vernachlässigt (aufgrund von Alkohol)
Entzugssymptome ( Zittern, Schweißausbrüche, Delirium, etc.)
kontinuierliche Erhöhung der Dosis um gleichen Effekt zu erzielen (Toleranzentwicklung)
Weiterführen des Konsums trotz eindeutlich schädlichen Folgen
Folgen für die Gesundheit:
Lebererkrankung (Schrumpfleber)
Krebserkrankung
Impotenz
Herzerkrankung
Übergewicht
Bluthochdruck
Entzündung der Bauchspeicheldrüse
Evtl. Psychische Störungen (Depressionen, Shizophrenie,etc.)
Was kann ich gegen eine Alkoholsucht machen?
Einen Arzt des Vertrauens aufzusuchen
Sich in einer Suchtberatungsstelle beraten zu lassen
Eine der zahlreichen Selbsthilfegruppen zu besuchen
Video: Die Phasen der Alkoholsucht - Welt der Wunder
Hier findest du einen Link zu einem YouTUbe-Video über die Alkoholsucht: Die Phasen der Alkoholsucht - Welt der Wunder
14 Zusammenfassung
Du hast nun gelernt, dass es neben dem bekannten Trinkalkohol (Ethanol) noch viele weitere Alkohole (Alkanole) gibt.
Ethanol kann im Gegensatz zu den anderen Alkanolen auch durch den Prozess der sogenannten alkoholischen Gärung gewonnen werden.
Nomenklatur und homologe Reihe der Alkanole
An welchem Kohlenstoffatom die Hydroxy-Gruppe gebunden ist, gibt die Ziffer vor der Endung “-ol” an. Die Kohlenstoffatome der längsten Kohlenstoffkette werden so nummeriert, dass die endständige Hydroxy-Gruppe der kleinstmöglichste Zahl zugeordnet wird.
Man unterscheidet zwischen primären, sekundären und tertiären Alkanolen.
Enthält ein Alkanol mehrere Hydroxy-Gruppen, spricht hier von einem mehrwertigen Alkanol.
Allgemeine Formel der einwertigen primären Alkanole:
Funktionelle Gruppe: Hydroxy-/-OH-Gruppe
Systematischer Name | Molekülformel | Strukturformel |
|---|---|---|
Methanol |  | |
Ethanol |  | |
Propan-1-ol |  | |
Butan-1-ol |  | |
Pentan-1-ol |  | |
Hexan-1-ol |  | |
... | ... | ... |
Stoffeigenschaften
Siedetemperatur
Du weißt jetzt, dass Alkanole aufgrund iherer stark polaren Hydroxy-Gruppe Wasserstoffbrücken zwischen den Molekülen ausbilden, wodurch die Siedetemperartur deutlich höher ist, als die der Alkane, Alkene und Alkine.
Löslichkeit
Dir müsste jetzt bekannt sein, dass Alkanole aufgrund ihrer Hydroxy-Gruppe sowohl einen polaren, als auch einen unpolaren Teil haben. Umso länger der unpolare Rest ist, desto schlechter sind sie in polaren Lösemittel (z.B. Wasser) löslich und umso besser in unpolaren (z.B. Benzin).
Oxidation von Alkoholen
Tertiäre Alkohole lassen sich nicht oxidieren, sekundäre können zu Ketonen oxidiert werden und primäre Alkohole reagieren (oxidieren) zu Aldehyden (meistens aber auch schnell weiter zu Carbonsäuren).
Alkohol als Sucht und Genussmittel
Tabelle 1: Homologe Reihe der primären Alkanole (ersetellt mit ChemSketch)
Dies sollst du dir gemerkt haben:
Grobe Berechnung des Blutalkoholkonzentration (BAK) in Promille durch Widmark-Formel:
Abbaurate schwankt zwischen 0,1 und 0,2 Promille pro Stunde je nach Mageninhalt, Geschlecht, Alter, usw.
Vorsicht: Regelmäßiger Alkoholkonsum kann sowohl zu einer psychischen wie auch zu einer körperlichen Abhängigkeit führen, was erhebliche Folgen für deine Gesundheit bedeuten kann!

Abbildung 17: Mann mit Kater (Quelle: Pixabay)
15 Quellen
Bücher
Chemie heute SI - Ausgabe 2006 für Bayern / naturwissenschaftlicher Zweig: Schülerband 10
Galvani - Ausgabe B 2008 - Für naturwissenschaftlich-technologische Gymnasien in Bayern: Band 3: 10. Jahrgangsstufe – Schülerbuch
Internetquellen
Süddeutsche Zeitung [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Geschichte-lernen.net [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Seilnacht [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Chemie.de [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Chemische-experimente.com [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Drugscouts.de [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
eve & rave Münster e.V. [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Drogen.wikia.com [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Chemieunterricht [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
Chemiezauber.de [zuletzt aufgerufen: 07.01.19, 18:00 Uhr]
