1 Einleitung
Stehen wir auf werden wir meistens von einem Wecker geweckt. Egal ob dieser mechanisch ist oder unser Handy als Wecker agiert, für beide Geräte ist Metall ein essenzieller Bestandteil.

Abb. 1: Wecker
Quelle: https://pixabay.com/de/zeit-wecker-uhr-stunden-minuten-2980690/
Alleine ein Smartphone besteht durchschnittlich zu 25 Prozent aus Metall und hat bis zu 30 verschiedene Metalle in sich verbaut.

Abb. 2: Smartphone
Quelle: https://pixabay.com/de/iphone-6-apple-ios-iphone-ios-8-458159/
Bereiten wir uns auf den anstehenden Tag vor, so benötigen wir fließendes Wasser und Strom. Und wer hätte es gedacht? Die Leitungen dafür bestehen zum Großteil aus Metall.

Abb. 3: Wasserleitung
Quelle: https://pixabay.com/de/wasserleitung-sanit%C3%A4r-rohrleitung-2852047/
2 Einleitung (2/2)
Stromleitungen zum Beispiel müssen aus leitfähigen Materialien bestehen und somit wird meistens Kupfer, ein weiches Metall, verwendet. Warum Metall ein guter Leiter für Elektrizität ist, wird sich in der folgenden Lerneinheit noch klären.

Abb. 4: Stromleitung
Quelle: https://pixabay.com/de/d%C3%A4mmerung-stromleitungen-abend-532720/
Wenn wir dann unseren Weg zur Schule oder zur Arbeit antreten, sind wir vor allem bei längeren Wegen auf ein Transportmittel angewiesen.
Ob es sich dabei um ein Fahrrad, ein Auto oder ein öffentliches Verkehrsmittel handelt, überall ist Metall verbaut.
Sei es der charakteristisch leichte Aluminium– oder Carbon-Rahmen bei dem Fahrrad, oder Gold, Silber, Kobalt und Kupfer in der Elektronik bis hin zu Aluminium und Eisen in der Karosserie von Autos und dem Fahrgestell von Zügen.
Dies zeigt, dass wir Metallen in unserem Alltag überall begegnen und sie für uns unverzichtbare Werkstoffe sind.

Abb. 5: Fahrrad
Quelle: https://pixabay.com/de/fahrrad-reifen-speichen-felge-2138131/
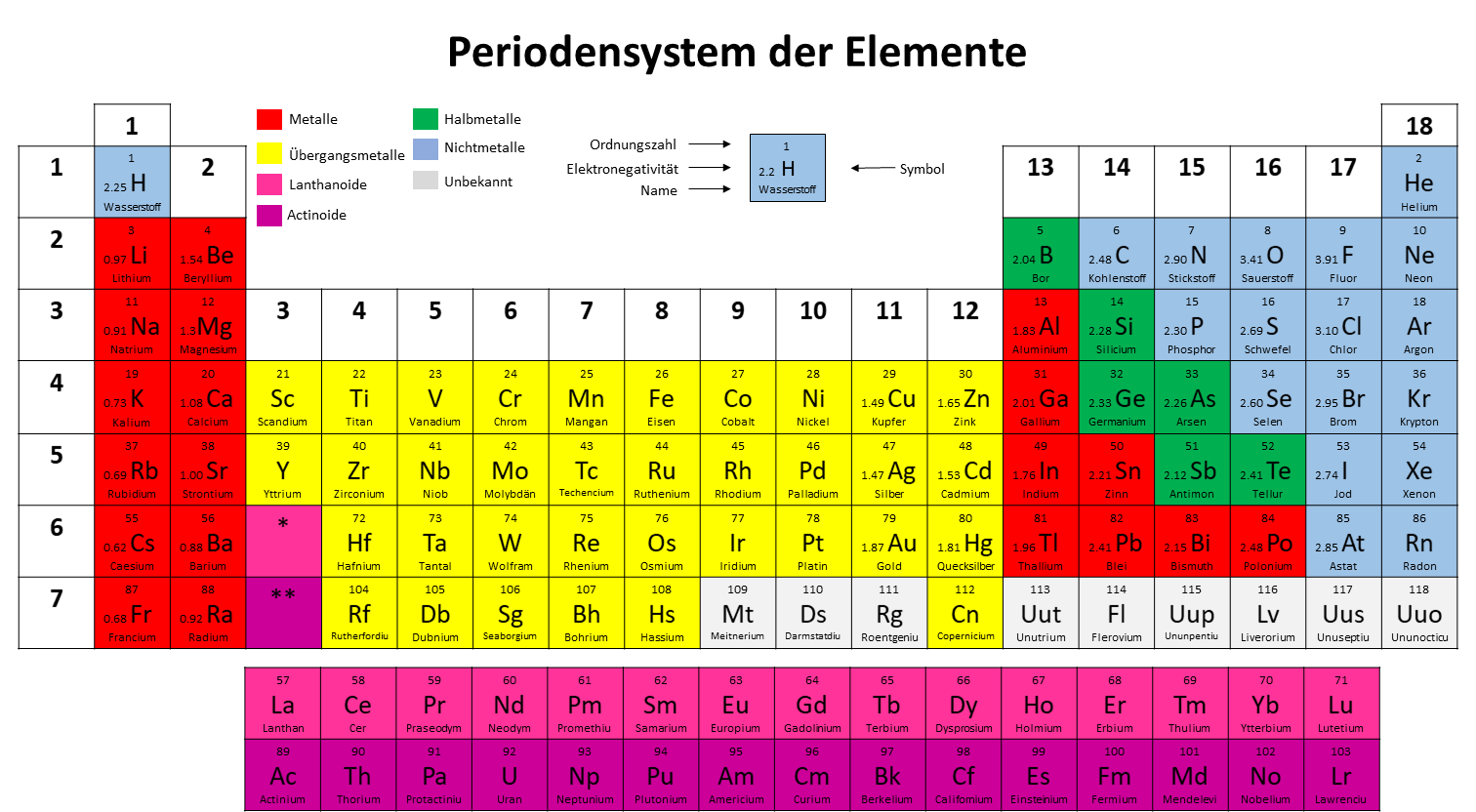
3 Metalle im Periodensystem (1/2)
4 Metalle im Periodensystem (2/2)
Man unterteilt diese Elemente in Metalle, Halbmetalle und Nichtmetalle.
Metalle haben eine glänzende Oberfläche, sind verformbar/dehnbar und weisen eine hohe Wärme– und elektrische Leitfähigkeit, sowie einen geringen elektrischen Widerstand und hohe Schmelz – und Siedetemperaturen auf.

Abb. 7: Metall
Quelle: https://pixabay.com/de/hintergrund-textur-metall-kratzer-1172581/
Nichtmetalle dagegen können durchsichtig sein, glänzen nicht und weisen weder eine gute Wärme – und elektrische Leitfähigkeit, noch eine gute Verformbarkeit auf.

Abb. 8: Nichtmetall (Phosphor)
Quelle: Fotografiert von BXXXD, nach der Lizenz GNU FDL
https://upload.wikimedia.org/wikipedia/commons/5/58/Wei%C3%9Fer_Phosphor.JPG
Halbmetalle sind Elemente, die Eigenschaften sowohl von Metallen, als auch von Nichtmetallen aufweisen.

Abb. 9: Halbmetall (Siliciumdioxid)
Quelle: Urheber Archaeodontosaurus, Lizensiert nach CC BY-SA 4.0
https://upload.wikimedia.org/wikipedia/commons/c/ce/Quartz_Br%C3%A9sil.jpg
5 Metallbindung
Metallatome geben ihre Valenzelektronen relativ leicht ab, da sie nicht sehr stark gebunden sind. Dadurch werden die Metallatome zu positiv geladenen Atomrümpfen, welche von negativ geladenen Elektronen umgeben sind.
Die Atomrümpfe sind dabei gitterartig angeordnet und werden von den frei beweglichen Elektronen durch elektrostatische Kraft zusammengehalten. Da die Elektronen in dem Gitter völlig frei beweglich sind, bezeichnet man sie auch als Elektronengas, denn auch Gase können sich relativ frei durch Materie bewegen.

Abb. 10: Metallbindung
6 Eigenschaften
Wärmeleitfähigkeit
Wird das Metall nun erhitzt, können die Elektronen die Wärmeenergie aufnehmen und wandeln sie in Bewegungsenergie um. In erhitztem Metall bewegen sich die freien Elektronen also mehr und schneller als in kaltem Metall. Wenn genug Wärmeenergie zugeführt wird, beginnen auch die Atomrümpfe sich zu bewegen. Durch die Bewegung der Elektronen kann die Energie dann schnell über das ganze Metall verteilt werden, wodurch sich Metalle schnell erhitzen, aber auch schnell wieder abkühlen.
Elektrische Leitfähigkeit
Wenn an ein Metall eine Spannung angelegt wird, entsteht ein Minuspol (mit einem Elektronenüberschuss) und ein Pluspol (mit Elektronenmangel). Die Elektronen, welche am Minuspol an dem Metall ankommen "schubsen" dann Elektronen welche sich weiter im Inneren befinden an. Dieses Schubsen wird fortgeführt, bis am Pluspol wieder Elektronen aus dem Metall "heraus geschubst" werden. So entsteht ein stetiger, gerichteter Fluss der Elektronen durch das Metall. Der sogenannte Stromfluss.
Bei höherer Temperatur nimmt die elektrische Leitfähigkeit übrigens ab, da die Elektronen häufiger mit den sich bewegenden Atomrümpfen zusammenstoßen und dadurch abgebremst werden.

Abb. 11: Elektrische Leitfähigkeit
Verformbarkeit
Wird mechanischer Druck auf Metall ausgeübt, so verschieben sich die Atomrümpfe zwar gegeneinander, aber die frei beweglichen Elektronen halten diese weiterhin zusammen. Deshalb bricht Metall nicht, sondern verformt sich stattdessen.
Manche Metalle lassen sich dabei leichter verformen als andere. So ist Gold beispielsweise sehr weich.
Früher hat man Goldmünzen von falschem Geld unterschieden, indem man hineingebissen hat, um zu gucken, ob ein Zahnabdruck auf dem Gold zu erkennen ist.
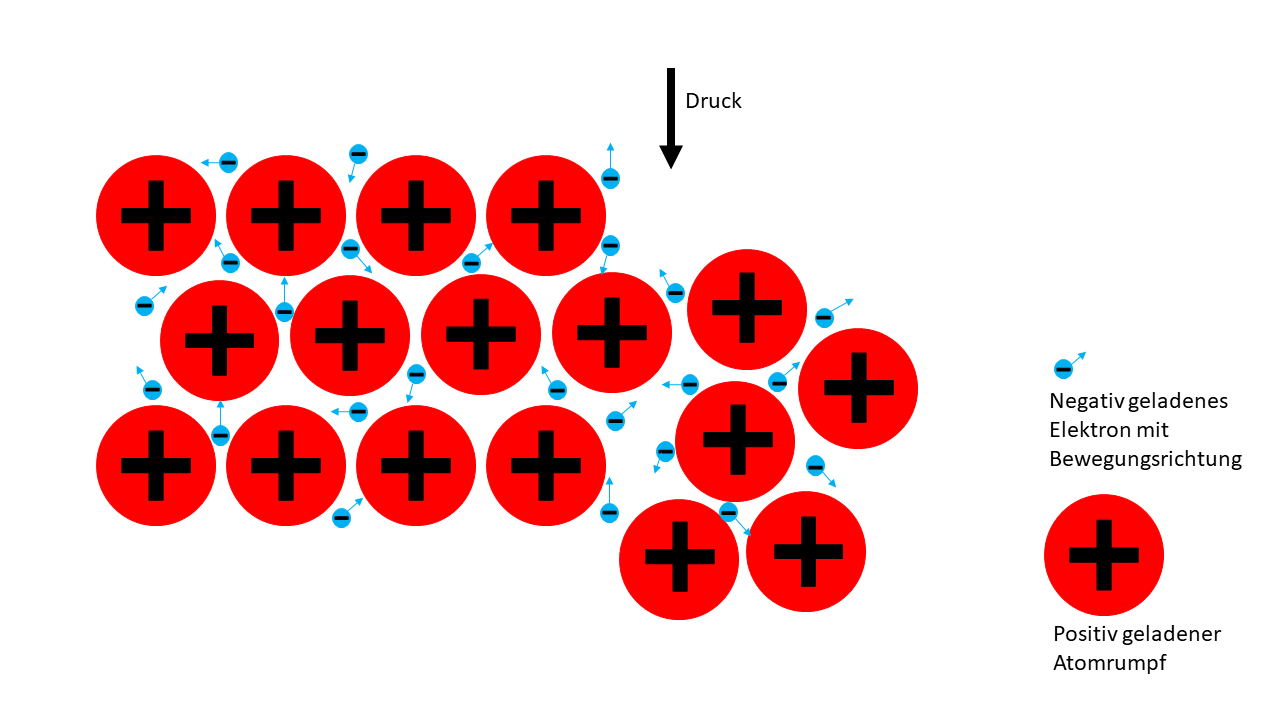
Abb. 12: Verformbarkeit
7 Legierungen
Eine Legierung ist ein Gemisch, das durch das Zusammenschmelzen verschiedener Metalle entsteht. Da die Atomrümpfe unterschiedlich groß sind, können sich die Kationenschichten nicht mehr so einfach verschieben und deswegen sind Legierungen schlechter verformbar als reine Metalle.
Eine schlechtere Verformbarkeit bedeutet allerdings auch, dass die Legierung härter ist als die reinen Metalle. Deshalb verwendet man Legierungen beispielsweise für den Brückenbau, da es hier unvorteilhaft wäre wenn die Brücke sich verbiegt.
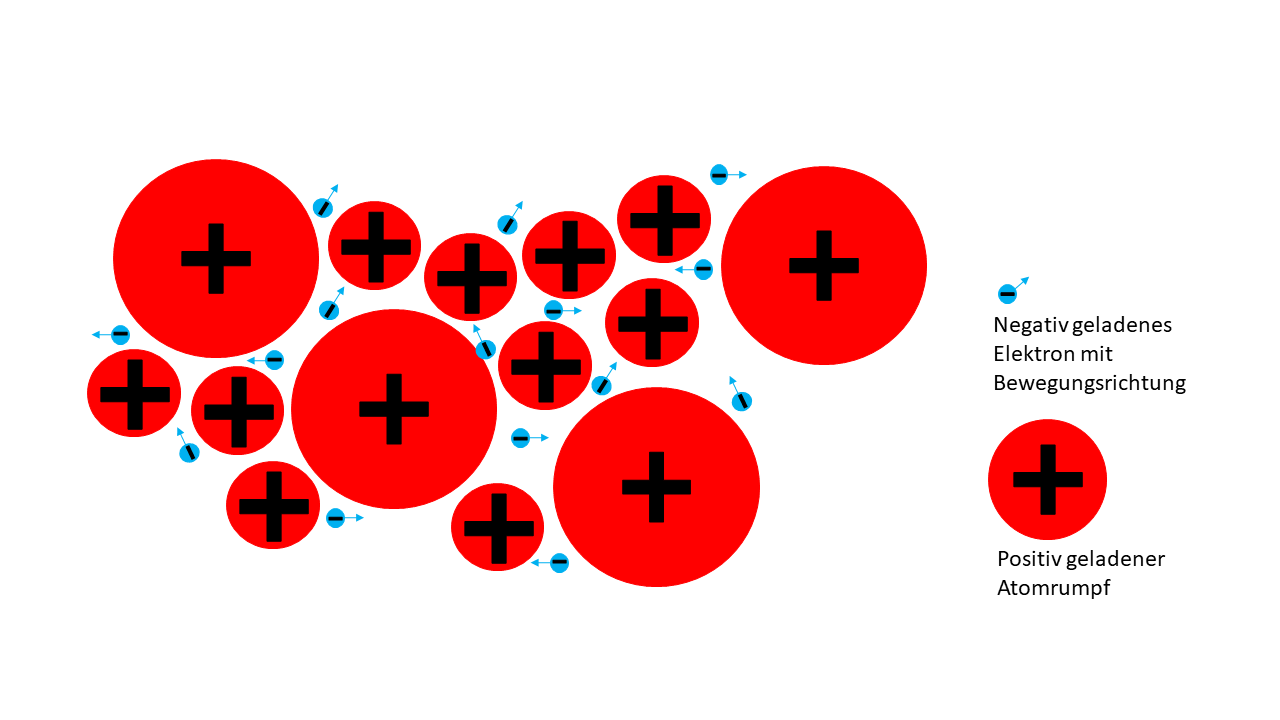
Abb. 13: Legierungen
8 Elektrolyse
Der Prozess der Elektrolyse beschreibt die Aufspaltung einer chemischen Verbindung mithilfe von Strom.
Dieses Verfahren wird zur Gewinnung von Metallen verwendet.
Elektrolyse von Zinkiodid
Bei dieser Elektrolyse werden zwei Elektroden in eine wässrige Lösung von Zinkiodid () getaucht.
In der Lösung liegen -Ionen und -Ionen vor.
Wird nun Spannung angelegt, so sammeln sich die positiv geladenen Zink-Ionen an der Kathode und nehmen jeweils 2 Elektronen auf, welche die Elektrode abgibt.
Somit erhält man elementares Zink.
An der Anode sammeln sich wiederum die negativ geladenen Iodid-Ionen und geben jeweils 1 Elektron ab und man erhält elementares Iod.
Aufgabe:
Versuche die Reaktionsgleichung für die Elektrolyse von Zinkiodid mithilfe der Erklärung aufzustellen.
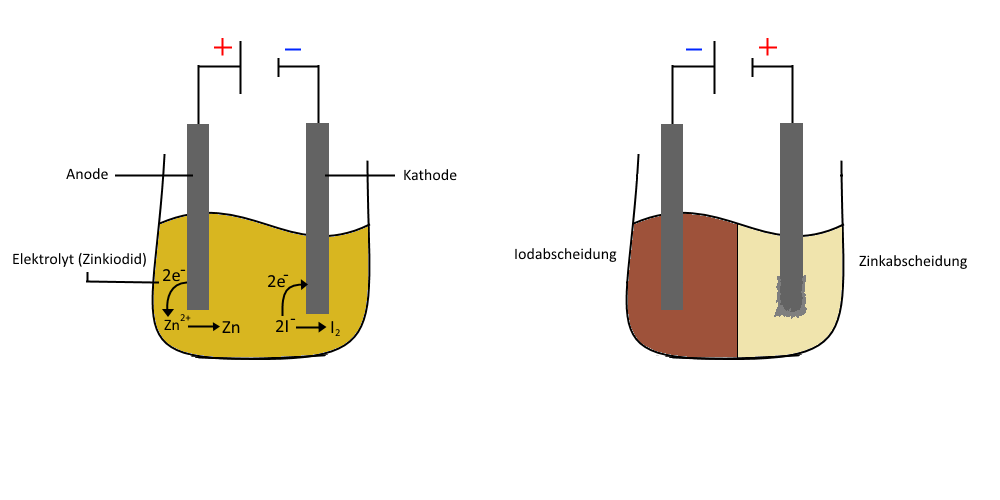
Abb. 14: Elektrolyse von Zinkiodid
9 Edelmetalle
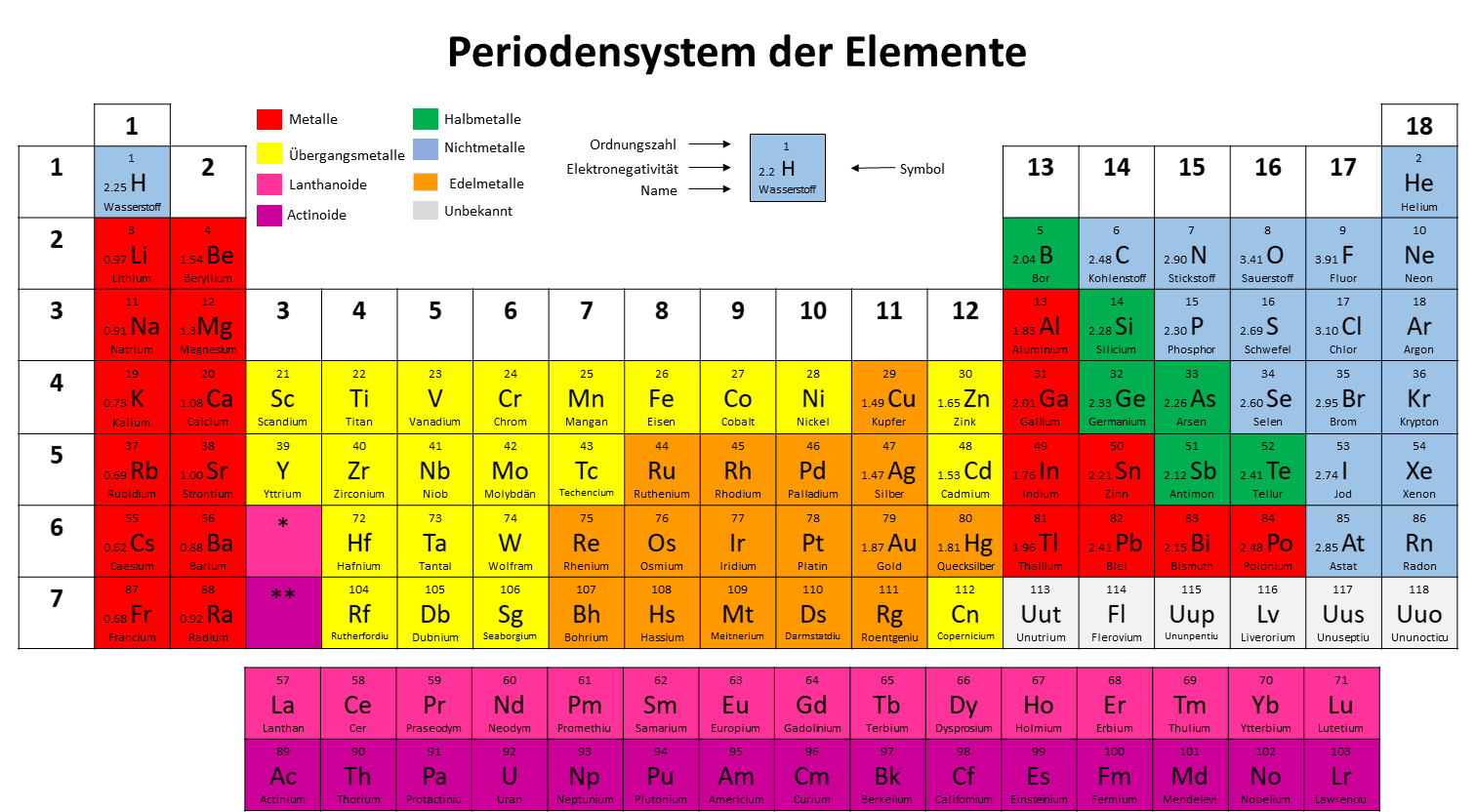
Abb. 15: Edelmetalle
Die Edelmetalle sind die hier in Orange markierten Elemente. Es handelt sich also um Nebengruppenelemente aus der Gruppe der Übergangsmetalle.
Edelmetalle sind korrosionsbeständige Metalle. Das heißt, dass sie in ihrer natürlichen Umgebung nicht mit anderen Stoffen reagieren. Deswegen rosten Edelmetalle beispielsweise nicht.
10 Versuch (1/2)
Versuchsaufbau
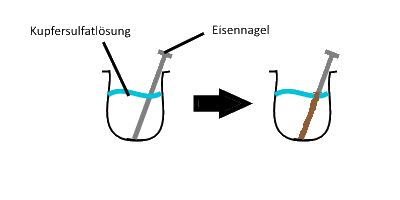
Abb. 16: Eisennagel in Kupfersulfatlösung
Beschreibung
Es bildet sich eine rot –bräunlicher Ablagerung am Eisennagel.
11 Versuch (2/2)
Erklärung
Die Eisenatome und die Kupfer-Ionen reagieren in einer Redoxreaktion zu Eisen-Ionen und Kupferatomen. Dabei geben die Eisenatome Elektronen ab und wirken als Elektronendonator und die Kupfer-Ionen nehmen Elektronen auf und wirken als Elektronenakzeptor.
Aufgabe:
Versuche die Reaktionsgleichung für die Reaktion eines Eisennagels in einer Kupfersulfatlösung mithilfe der Erklärung aufzustellen.
12 Aufgaben
1.
Stelle die Reaktionsgleichung für die Elektrolyse von Zinkbromid auf.
2.
Stelle die Reaktionsgleichung für die Reaktion von Magnesium mit Kupferoxid auf.
13 Quellen
Chemie heute Bayern 8: Westermann: 2008
Metalle - Strukturen und Eigenschaften der Metalle und Legierungen; Hornbogen, E.; Warlimont, H.; 2016