Metalle machen 80% der bekannten Elemente aus. Dementsprechend gibt es auch viele sehr unterschiedliche Metalle mit sehr unterschiedlichen Eigenschaften.
Trotzdem gibt es einige Eigenschaften, welche allen Metallen gemein sind.
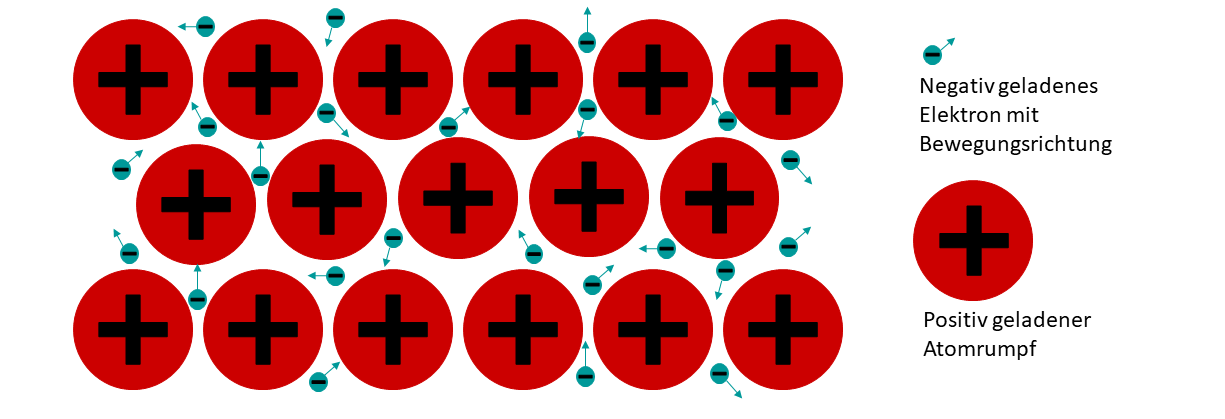
Die im folgenden erklärten Eigenschaften lassen sich alle mit dem typischen Aufbau von Metallen erklären. Metalle bestehen aus regelmäßig, gitterartig angeordneten Atomen. Metall-Atome besitzen generell nur wenige Valenzelektronen, welche sie sehr leicht abgeben können. Dadurch entsteht ein Metallgitter aus positiv geladenen Atomrümpfen, welche durch Elektrostatische Kräfte (wie zwischen zwei Magneten) von negativ geladenen Elektronen zusammengehalten werden.
Diese Elektronen können sich absolut frei zwischen den Atomrümpfen bewegen und verhalten sich dabei ähnlich wie ein Gas. Daher kommt auch der Name Elektronengasmodell.
Oberflächenglanz
Jeder, der schon einmal Aluminiumfolie gesehen hat, weiß, sie hat einen typischen silbrigen Glanz.
Alle metallischen Oberflächen besitzen diesen typischen Glanz. Er entsteht dadurch, dass die frei beweglichen Elektronen sehr gut Licht reflektieren können.

Da der Glanz von Metallen vielerorts als Ästhetisch angesehen wird, spielt Metall in der Schmuckherstellung eine große Rolle.
Wärmeleitfähigkeit
Metalle sind sehr gute Wärmeleiter. Das bedeutet, dass sich eine Erwärmung an einem Punkt sehr schnell durch den gesamten Stoff ausbreitet. Genauso schnell wie Metalle sich erwärmen können kühlen sie allerdings auch wieder ab. Man kann also auch sagen, dass sich Metall allgemein sehr schnell an die umgebende Temperatur anpasst.
Wird ein Metall erwärmt, so wird ein Teil der Wärme in Bewegungsenergie umgewandelt. Dadurch beginnen die Atomrümpfe zu vibrieren und die freien Elektronen bewegen sich schneller durch das Metallgitter.

Da Metalle sich sehr schnell erhitzen und diese Hitze auch gut an ihre direkte Umgebung weitergeben können werden sie häufig zur Herstellung von Töpfen und Pfannen, aber auch Backblechen verwendet.
Elektrische Leitfähigkeit
Legt man an ein Metall eine Spannung an, kann ein Strom durchfließen. Dabei bewegen sich die Elektronen in dem Metall in Richtung des Pluspols, während vom Minuspol neue Elektronen nachkommen.
Das funktioniert ähnlich wie ein mit Wasser gefüllter Wasserschlauch. Solange dieser einfach auf dem Boden liegt, bewegt sich das Wasser darin nicht. Schließt man ihn jedoch an beiden Enden an eine Wasserpumpe an, wird durch das nachfließende Wasser vorne Wasser aus dem Schlauch herausgedrückt.


Aufgrund der guten elektrischen Leitfähigkeit von Metallen werden diese für den Bau von Stromkabeln verwendet. Speziell wird dafür meist Kupfer verwendet, da dieses Metall nicht zu teuer ist und besonders gut leitet.
Hohe Schmelz- und Siedetemperaturen
Durch die sehr regelmäßige Anordnung der Atomrümpfe in Metallen und die starken Anziehungskräfte zwischen den Elektronen und den Atomrümpfen sind Metalle extrem stabil.
Das bedeutet auch, dass sie erst bei sehr hohen Temperaturen schmelzen und sieden. Deshalb sind auch nahezu alle Metalle bei Raumtemperatur fest.
Ausnahmen sind Cäsium, Quecksilber und Gallium. Diese Metalle sind bei Raumtemperatur flüssig.

Quelle: Dblay, CC BY-SA 3.0, Wikimedia Commons
Flüssiges Gallium, welches an der Oberfläche beginnt zu kristallisieren.
Verformbarkeit
Die Verformbarkeit bezeichnet das Verhalten, dass Stoffe zeigen, wenn man versucht ihre Form mit mechanischer Kraft zu verändern. Es gibt drei typische Varianten, wie sich ein Feststoff dabei verhalten kann: Er kann sich verformen lassen, er zerbricht bei dem Versuch ihn zu verformen oder kehrt nach der Verformung wieder in seine ursprüngliche Form zurück.
Einige Stoffe, wie etwa Metalle, sind verformbar. Das heißt, man kann ihre Form ändern und sie bleibt dann auch so bestehen.
Diese Verformbarkeit hängt mit der Struktur von Metallgittern zusammen. Wird mechanischer Druck auf ein Metallgitter ausgeübt, so werden die positiv geladenen Atomrümpfe gegeneinander verschoben. Da die negativ geladenen Elektronen sich frei bewegen können, halten sie die Atomrümpfe auch nach dem Verschieben noch zusammen.
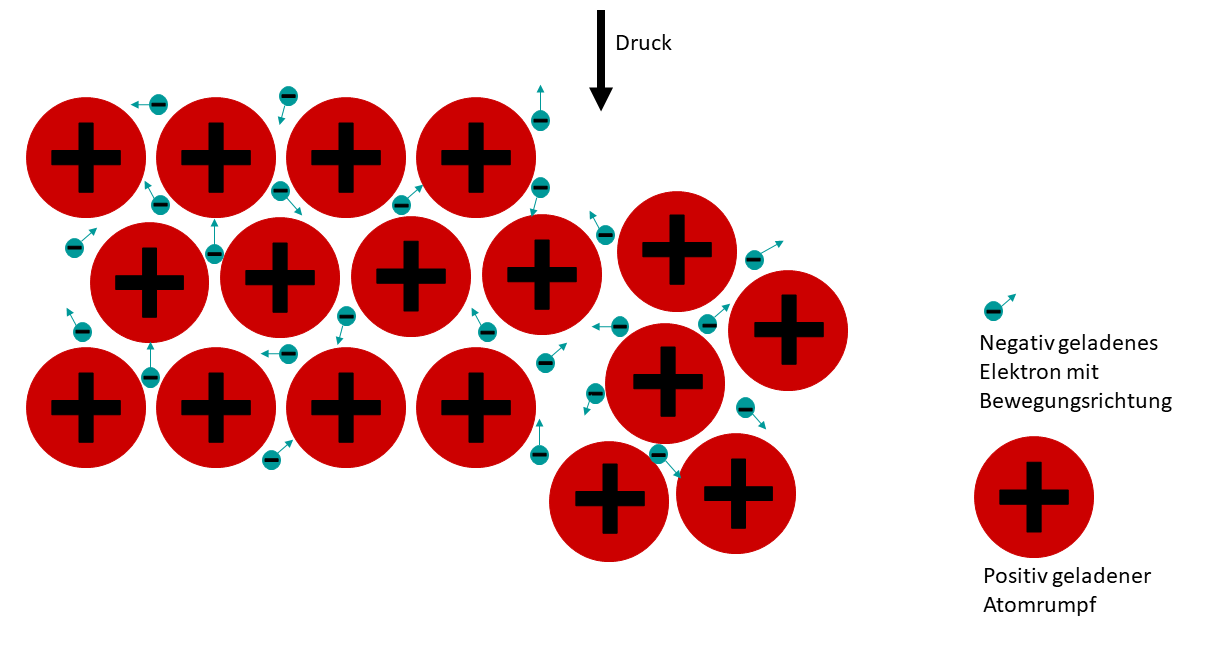
Für die Verformbarkeit von Metall gibt es verschiedene Anwendungen:
Beim sogenannten Treiben wird ein Blech meist im kalten Zustand verformt. Bereits im Altertum war diese Technik der Metallbearbeitung etwa vom Kupfer bekannt.
Das Dengeln ist ein Verfahren zum Schärfen der Schneide einer Sense, die durch Hämmern ausgetrieben wird.
Gold ist auch deshalb ein beliebtes Schmuckmetalle, da es leicht zu verformen ist.
Andere Stoffe lassen sich zwar verformen, aber sie behalten ihre neue Form nicht bei. Man bezeichnet dieses Verhalten als elastisch. Das kennt man vor allem von Gummi aber auch Federn bezeichnet man elastisch. Dabei kommt die große Elastizität nicht vom Werkstoff selber, sondern mehr von der Form, wie es auch bei Schaumstoff der Fall.
Zerbricht ein Stoff, wenn man ihn versucht zu verformen, dann nennt man ihn spröde. Das kennt man im Alltag von einigen Stoffen, wie Salz oder einigen Plastiksorten. Aber auch Gestein und Kristalle sind spröde.
Härte
Als Härte bezeichnet man den Widerstand, den ein Stoff gegen die Eindringung eines Prüfkörpers entgegensetzt.
Weiche Stoffe lassen sich leicht auch mit dem Fingernagel eindrücken. Harte Stoff dagegen lassen sich nur mit sehr festen Gegenständen eindrücken.
Bei Mineralien nutzt man eine bestimmte Untersuchungsmethode um Mineralien nach ihrer Härte zu sortieren. Mit Hilfe der sogenannten Mohsschen Härteskala hat man einen einfache Untersuchungsmöglichkeit. Deshalb haben Mineraliensammler meist eine kleine Sammlung an Mineralien in einem Kästchen, nach der Härte sortiert, dabei.
Die Untersuchung folgt dabei dem Prinzip, dass harte Stoffe weiche ritzen können. Mohs war ein Geologe und er ritzte verschiedene Mineralien gegeneinander und ordnete sie so nach ihrer Härte. Er legte Zahlen für bestimmte Referenz-Mineralien fest, die es in einem Kasten zusammen zu kaufen gibt. So hat Diamant als härtestes Mineral die Mohs-Härte
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
