Begründe ausführlich ob und wenn ja warum es sich bei folgenden Reaktionen um RedOx-Reaktionen handelt.
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
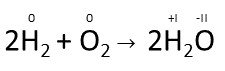
Bestimme zunächst alle Oxidationszahlen.
Die Oxidationszahlen der Atome ändern sich mit der Reaktion.
Bei der Oxidationsreaktion nimmt die Oxidationszahl zu, da Elektronen abgegeben werden.
Dei der Reduktionsreaktion nimmt die Oxidationszahl ab, da Elektronen aufgenommen werden.
Die Wasserstoffatome werden oxidiert, sie geben jeweils ein Elektron ab und ihre Oxidationszahl erhöht sich somit jeweils von 0 zu +I.
Die Sauerstoffatome werden reduziert, sie nehmen jeweils zwei Elektronen auf und ihre Oxidationszahl verringert sich von 0 zu -II.
Da sowohl eine Oxidations- als auch eine Reduktionsreaktion stattfindet handelt es sich hier um eine RedOx-Reaktion.
Hast du eine Frage oder Feedback?
Bestimme zunächst alle Oxidationszahlen und überlege dir, was genau eine RedOx-Reaktion ausmacht.
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
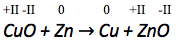
Bestimme zunächst alle Oxidationszahlen.
Die Oxidationszahlen der Atome ändern sich mit der Reaktion.
Bei der Oxidationsreaktion nimmt die Oxidationszahl zu, da Elektronen abgegeben werden.
Dei der Reduktionsreaktion nimmt die Oxidationszahl ab, da Elektronen aufgenommen werden.
Das Zinkatom wird oxidiert, es gibt zwei Elektronen ab und seine Oxidationszahl erhöht sich somit von 0 zu +II.
Das Kupferatom wird reduziert, es nimmt zwei Elektronen auf und seine Oxidationszahl verringert sich von +II zu 0.
Somit handelt es sich auch hierbei um eine Redoxreaktion.
Da sowohl eine Oxidations- als auch eine Reduktionsreaktion stattfindet handelt es sich hier um eine RedOx-Reaktion.
Hast du eine Frage oder Feedback?
Bestimme zunächst alle Oxidationszahlen und überlege dir, was genau eine RedOx-Reaktion ausmacht.
Dieses Werk steht unter der freien Lizenz
CC BY-SA 4.0 → Was bedeutet das?
