In diesem Artikel wird erklärt, wie und warum Rotkohlsaft in einem Experiment Zuhause als pH-Indikator genutzt werden kann.
Rotkohlsaft kann als Indikator verwendet werden, der, je nachdem ob eine Flüssigkeit sauer oder alkalisch reagiert, die Farbe ändert. Dadurch lassen sich auch schöne bunte Flüssigkeiten herstellen.

Bildquelle: Supermartl, Wikimedia Commons, CC BY-SA 3.0
Rotkohlsaft Herstellung
Rotkohlsaft ist also ein pH-Indikator, da er den pH-Wert einer Lösung anzeigen kann. Der pH-Wert misst zwischen 1 und 14 wie sauer oder alkalisch eine Lösung ist. Ein Wert von 7 zeigt an, dass eine Lösung neutral ist, wie beispielsweise Wasser.
Rotkohlsaft kannst du dir ganz einfach zu Hause selber herstellen, um Flüssigkeiten auf ihren pH-Wert zu testen. Wie das geht, siehst du im Folgenden.
Material
Rotkohl (einige Blätter reichen)
Wasser
Topf
Durchführung
Je nach gewünschter Menge können einige Blätter bis hin zu einem ganzen Kopf Rotkohl verwendet werden. Dieser muss zuerst mit einem Messer zerkleinert werden, dabei gilt, je kleiner die Stücke, desto schneller kann der Farbstoff daraus in das Wasser abgegeben werden.
Bildquelle: congerdesign, Pixnio

Danach müssen die Rotkohl-Stücke in einem Topf mit Wasser bedeckt werden, bevor das Ganze dann etwa 10 Minuten gekocht werden kann.
Bildquelle: Flickr

Zuletzt muss der Rotkohlsaft durch ein Sieb abgeschüttet werden, um die Rotkohl-Stücke herauszufiltern.
Bildquelle: Pixabay

Achtung
Der Rotkohlsaft kann Flecken auf Kleidung und Haut verursachen. Gehe also vorsichtig damit um.
Achte beim Abgießen des Saftes darauf, dass du dich am heißen Wasser nicht verbrennst.
Verwendung
Den Rotkohlsaft kannst du nun für verschiedene Experimente verwenden. Für spätere Verwendung kannst du den Saft übrigens auch einfrieren oder einige Tage im Kühlschrank aufbewahren.
Gib etwas Saft auf einen Teller und lege einen Kaffeefilter darauf. Sobald die gesamte Flüssigkeit getrocknet ist, kannst du das Papier als pH-Indikator verwenden. Dafür tauchst du einfach ein kleines Stück Papier in die zu untersuchende Flüssigkeit und siehst wie die Farbe sich verändert.
Gib etwas Saft in ein Glas mit einer zu untersuchenden Flüssigkeit und sieh dir an wie die Farbe sich verändert.
Wenn du Regenbogen-Flüssigkeiten wie oben in dem Bild erstellen willst, kannst du folgende Mixturen ansetzen.
Regenbogen-Flüssigkeiten
Material
7 Gläser
Zitronensaft
Essig
Limonade
Leitungswasser
Backpulver oder Natron
Waschpulver
Spülmittel oder Rohrreiniger
Durchführung
Befülle die Gläser etwa zur Hälfte mit Wasser und gib dann die folgenden Mischungen dazu:
zwei Esslöffel Zitronensaft
zwei Esslöffel Essig
zwei Esslöffel Limonade
nichts
ein Teelöffel Backpulver oder Natron
ein Teelöffel Waschpulver
etwas Spülmittel oder 1 Teelöffel Rohrreiniger
Fülle die Gläser dann mit Rotkohlsaft auf und bewundere dein Ergebnis.

Achtung
Spülmittel ist manchmal pH-neutral, dann eignet sich Rohrreiniger besser.
Rohrreiniger ist jedoch extrem basisch achte also darauf, das s er nicht mit deiner Haut in Berührung kommt.
Erklärung
Der Rotkohl erhält seine Farbe von den Farbstoffen Anthocyane. Diese Farbstoffe können rot, pink, lila oder blau erscheinen.
Sie färben unter anderem auch Brombeeren, Himbeeren und die meisten blauen und lilanen Blüten.
Dort dienen sie vor allem als UV-Schutz, ähnlich wie beim Menschen das Melanin.
Bildquelle: Tim Reckmann, CCNull, CC-BY 2.0

Dabei ändern Anthocyane die Farbe, je nachdem ob sie mit sauren (Zitronensaft, Essig, Limonade) oder seifigen (Backpulver, Natron, Reinigungsmittel) Flüssigkeiten gemischt wird.
Diese Flüssigkeiten nennt man auch Säuren und Laugen. Je nach Stärke der Säure oder Lauge (pH-Wert) ergeben sich dann verschiedene Farben.
Diese Indikator-Eigenschaft hängt mit der Struktur des Farbstoffes zusammen. Dabei spielen insbesondere die freien Elektronenpaare (Doppelstriche/ -punkte in der Abbildung) eine wichtige Rolle. Denn diese verändern ihre Position je nach pH-Wert. Dadurch verändert sich das Absorptionsverhalten des Farbstoffes, weshalb andere Farben reflektiert werden.
Oder kurz gesagt, die von uns wahrgenommene Farbe ändert sich.
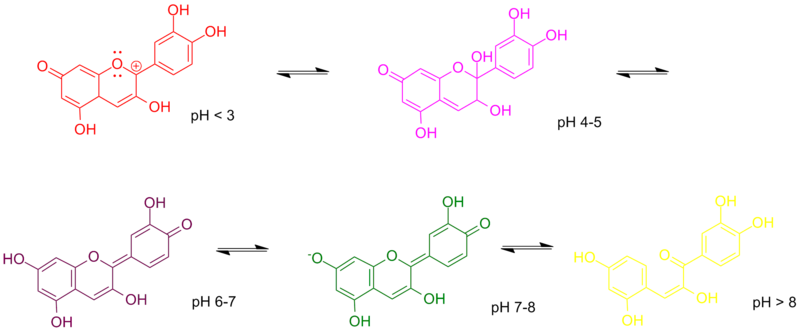
Bildquelle: PigAndPepper, Die-Chemie-Schule, public domain

