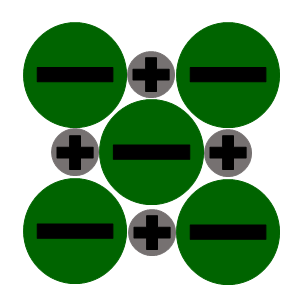
Salze haben in Wasser eine sehr hohe Löslichkeit. Du kennst das vielleicht, wenn du schon einmal eine Suppe gesalzen hast, das Salz löst sich in der Suppe und liegt nicht körnig vor.
Im Folgenden wollen wir uns anschauen, wie genau der Lösungsvorgang von Salzen in Wasser aussieht.
Die beteiligten Teilchen
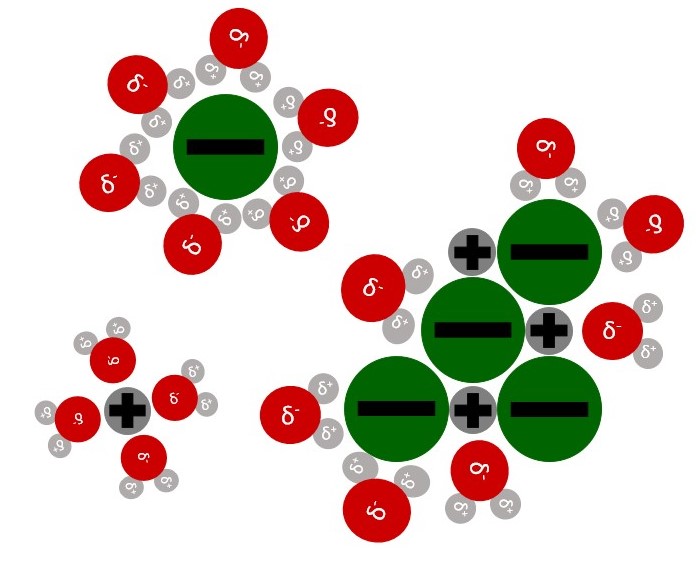
Wassermoleküle sind Dipole, das heißt, sie besitzen positive und negative Partialladungen (). Diese entstehen durch die unterschiedlichen Elektronegativitäten der Atome.
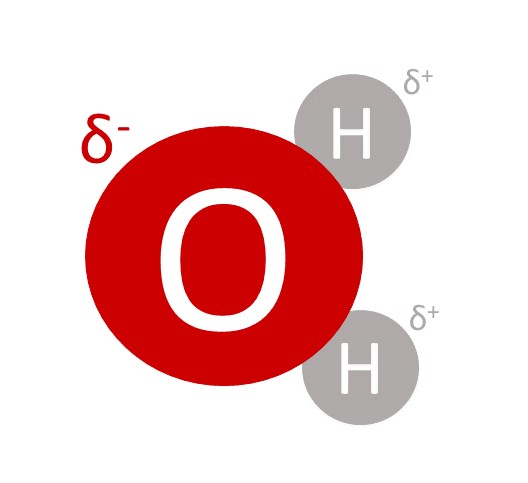
Der Lösungsvorgang
Gibt man Salzkristalle in Wasser, richten sich die Wassermoleküle so aus, dass positive Teilladungen an Anionen haften und negative Teilladungen an Kationen.
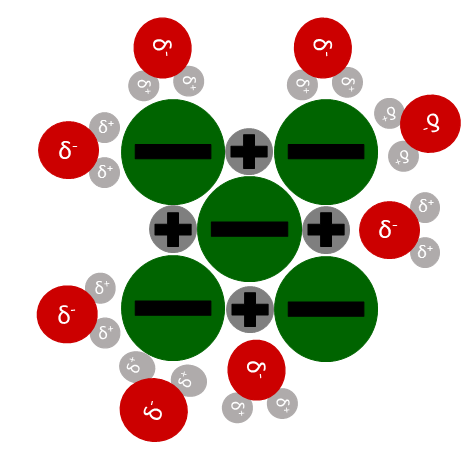
Durch die Wechselwirkungen zwischen den Wassermolekülen und den Ionen, werden die Ionen langsam aus dem Gitter gezogen.
Dafür muss die Bindungsenergie zwischen den Ionen überwunden werden. Diese Energie heißt auch Gitterenergie.
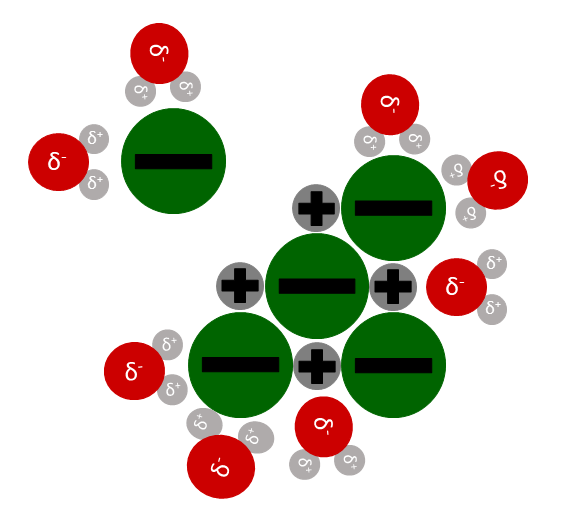
Zuletzt werden die gelösten Ionen von Wassermolekülen umgeben. Das nennt man die Hydrathülle.
Diesen Schritt nennt man auch Hydratation. Hier wird Energie frei. Diese Energie heißt Hydrationsenergie.
Bedeutung der Energiebeträge
Mithilfe der Hydrationsenergie und der Gitterenergie kann berechnet werden, ob beim Lösungsvorgang Energie frei wird, oder ob Energie aufgenommen wird.
Wird Energie frei, spricht man von einer exothermen Reaktion. Das Reaktionsgemisch erwärmt sich.
Wird Energie aufgenommen, spricht man von einer endothermen Reaktion. Das Reaktionsgemisch kühlt ab.
Passiert nichts von beidem, bleibt die Temperatur gleich.
Um festzustellen, ob die Reaktion endotherm oder exotherm abläuft, wird der Betrag der Gitterenergie vom Betrag der Hydratationsenergie abgezogen.
Ist das Ergebnis negativ, wird Energie aufgenommen, die Reaktion ist endotherm, die Umgebung kühlt ab.
, die Umgebung kühlt ab.
Ist das Ergebnis positiv, wird Energie abgegeben, die Reaktion ist exotherm, die Umgebung wärmt sich auf.
Ist das Ergebnis Null, wird Energie weder aufgenommen noch abgegeben. Die Reaktion ändert die Temperatur nicht.