Besetzungsregeln
Nach dem Orbitalmodell erfolgt die Elektronenbesetzung nach folgenden Regeln:
In jedem Orbital können maximal 2 Elektronen sein
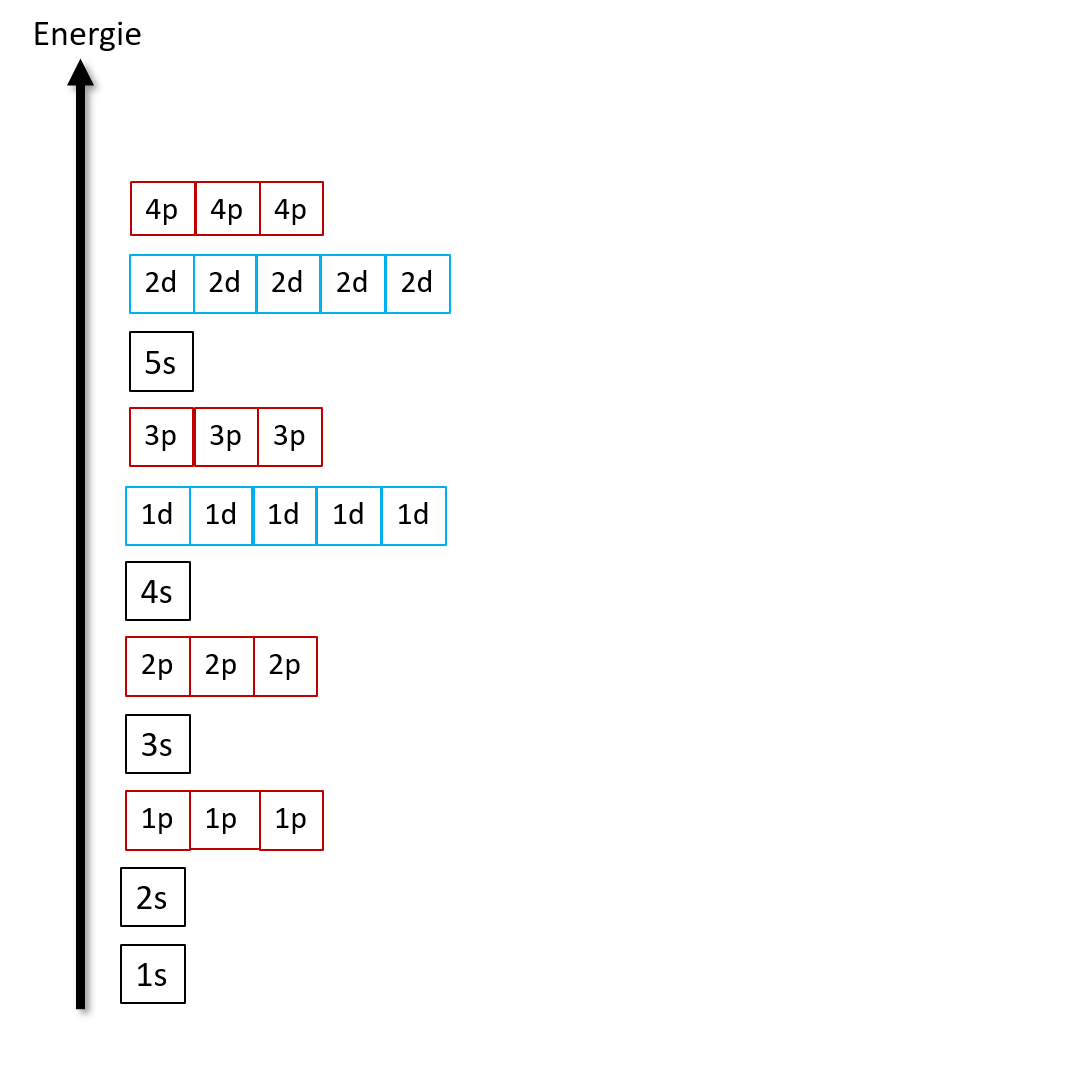
Die Besetzung der Orbitale mit Elektronen erfolgt nach dem Prinzip geringster Energie. Das bedeutet, dass zuerst die energieärmeren Orbitale besetzt werden. In dem neben stehenden Diagramm kannst du ablesen, welche Orbitale energiereicher und welche energieärmer sind. Also zuerst wird das 1s Orbital befüllt, dann das 2s, dann die drei 1p Orbitale usw.
Zusätzlich muss bei jedem Elektron die Hund'sche Regel und das Pauli Prinzip beachtet werden
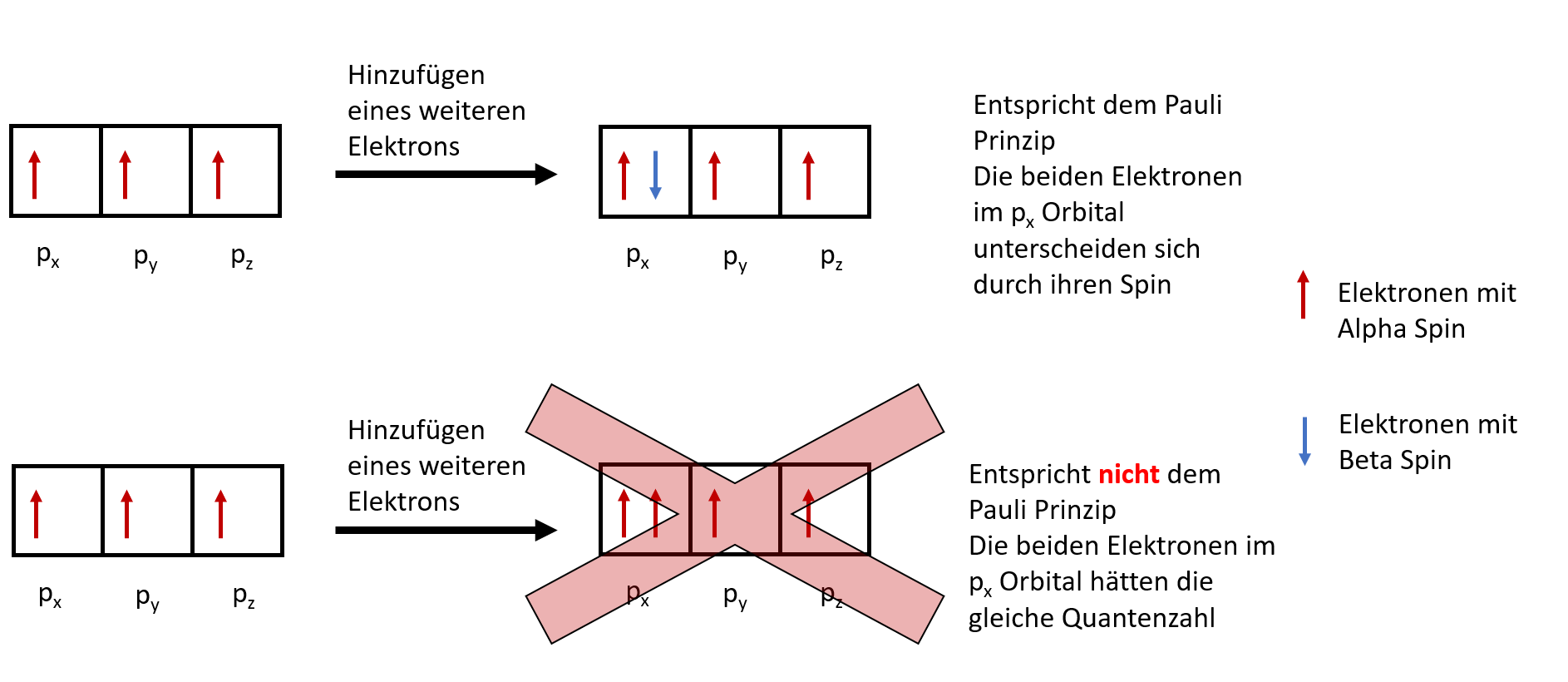
Pauli Prinzip
Nach W. Pauli dürfen zwei Elektronen nie in allen vier Quantenzahlen übereinstimmen. Was die Quantenzahlen sind, kannst du im Artikel "Orbitale und ihre Quantenzahlen" nachlesen.
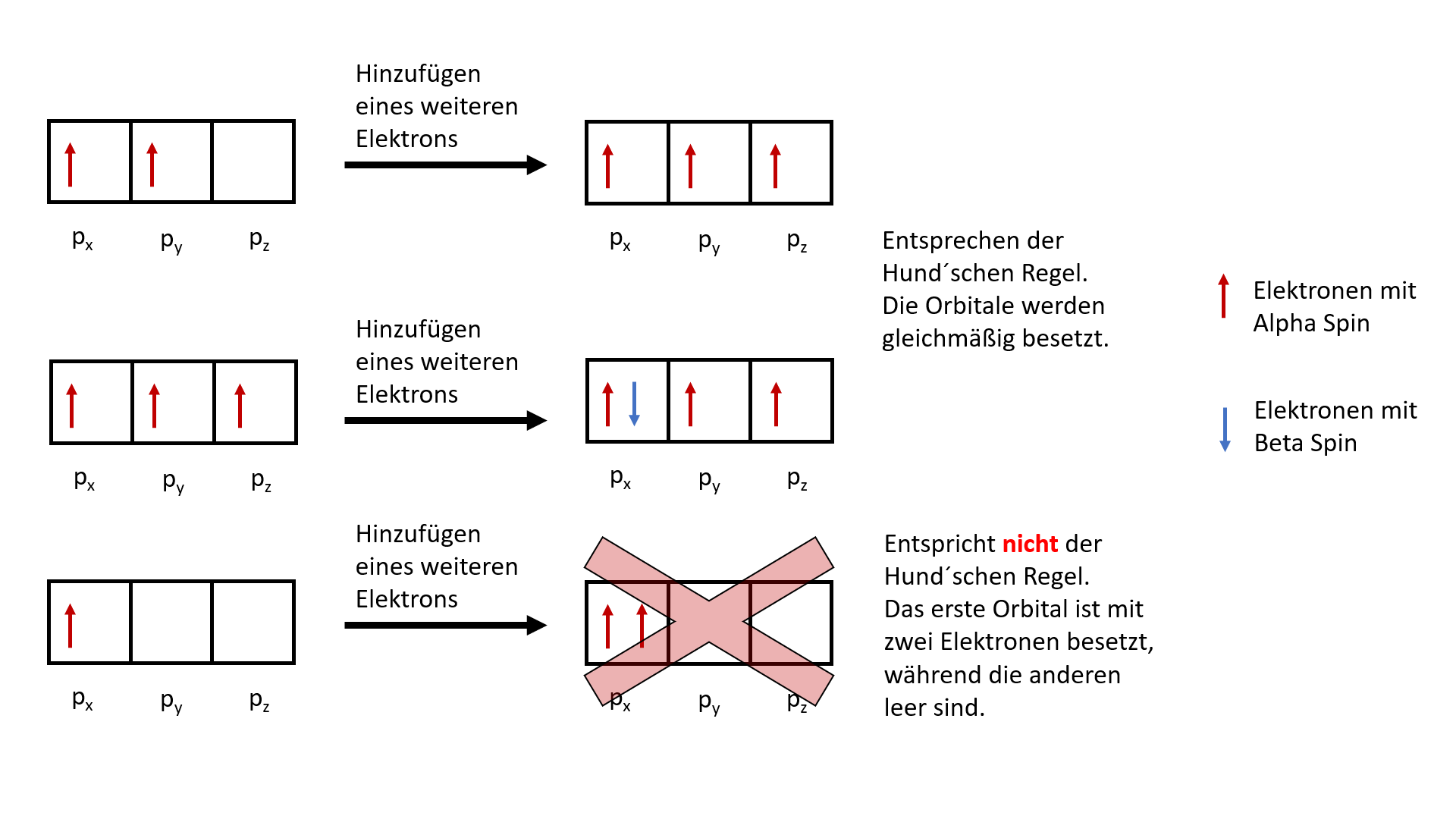
Hund'sche Regel
Orbitale mit dem gleichen Energieniveau (also beispielsweise jedes der drei p-Orbitale) werden zuerst mit jeweils einem Elektron besetzt. Erst wenn alle diese Orbitale ein Elektron aufgenommen haben, kann ein Orbital dieses Energieniveaus ein weiteres Elektron aufnehmen.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
