Alkane sind in der freien Natur vorkommende Kohlenwasserstoffverbindungen. Sie bestehen aus Kohlenstoffatomen und Wasserstoffatomen, C- und H-Atomen. Zwischen den C- und H-Atomen bestehen bei Alkanen nur Einfachbindungen.
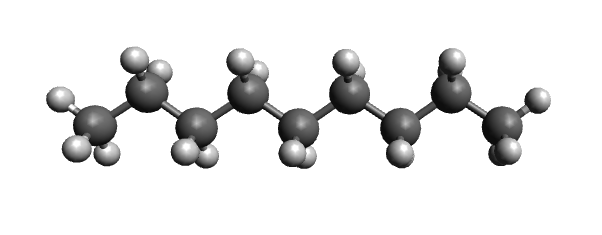
Hier ist das Alkan "Nonan" abgebildet. Die Summenformel von Nonan ist .
Vorkommen
Alkane sind in Erdgas, Erdöl und in der belebten Natur zu finden. Beispielsweise entsteht Methan bei der Fermentation von organischen Molekülen und wird oft als Biogas betitelt.
Durch die vielfältige Nutzung des Erdöls haben die Alkane eine große technische Bedeutung erlangt. Es gibt eine Vielfalt von Erdölprodukten, vor allem im Kunststoffbereich, die unseren Alltag stark prägt.

Die homologe Reihe der Alkane
Die allgemeine Summenformel der nicht-verzweigten Alkane lautet .
Die nicht-verzweigten Alkane werden auch als n-Alkane bezeichnet (n="normal", d.h keine Seitenketten).
Iso-Alkane
Iso-Alkane besitzen Seitenketten, im Gegensatz zu n-Alkanen. "Iso-" ist dabei die Abkürzung für Isomer.
Isomere sind chemische Verbindungen mit der gleichen Summenformel, aber unterschiedlicher Struktur.
Je mehr Kohlenstoffatome das Alkan besitzt, desto mehr Isomere sind möglich. Butan () besitzt beispielsweise nur ein Isomer, während Nonan () 34 Isomere besitzt.
Dabei ist jedoch zu beachten, dass der Großteil dieser Isomere nur in der Theorie existieren, in der Realität jedoch nur selten oder kurz auftreten.
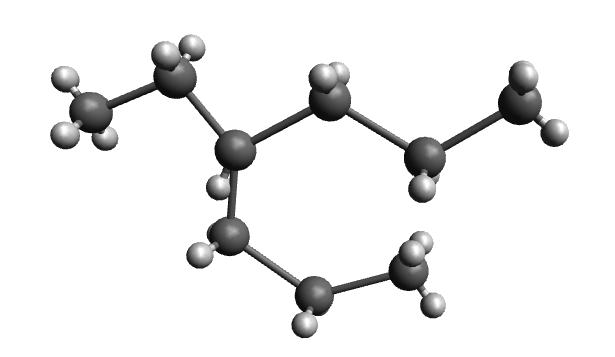
Hier ist ein Isomer von dem Alkan "Nonan" abgebildet. Die Summenformel von Nonan ist .
Eigenschaften von Alkanen
Alkane sind sehr stabil, weshalb sie nicht sehr reaktiv sind. Zudem besitzen Alkane keine funktionellen Gruppen welche Reaktionen begünstigen. Die einzigartige Struktur von n-Alkanen führt zudem zu bestimmten Eigenschaften, wie den Siede- und Schmelztemperaturen.
Siede- und Schmelztemperaturen
Innerhalb der homologen Reihe der Alkane steigen die Siedetemperaturen mit zunehmender Kettenlänge. In der unten stehenden Graphik sind Schmelzpunkte in blau und Siedepunkte in rot angezeigt. Die Zahlen auf der X-Achse stehen für die Anzahl der Kohlenstoffatome in dem jeweiligen Alkan.
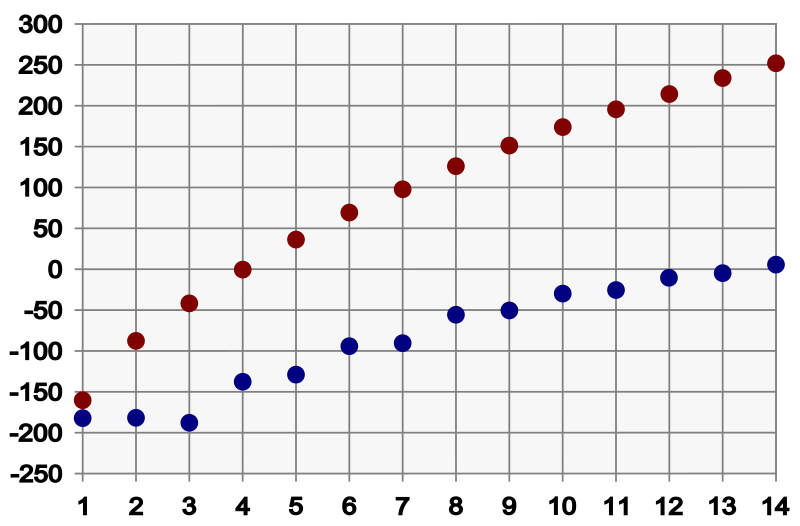
Das liegt daran, dass zwischen den Molekülen Van-der-Waals Kräfte herrschen. Je länger die Moleküle sind, desto mehr Van-der-Waals Kräfte können sich ausbilden. Damit wird der Zusammenhalt zwischen den Molekülen stärker je länger diese sind.
Bei sehr langen Alkanen (über 25 -Atome) sind die Van-der-Waals Kräfte so stark, dass diese nicht mehr sieden können.
Was ist der Grund dafür, dass Alkane über 25 C-Atome nicht mehr sieden können?
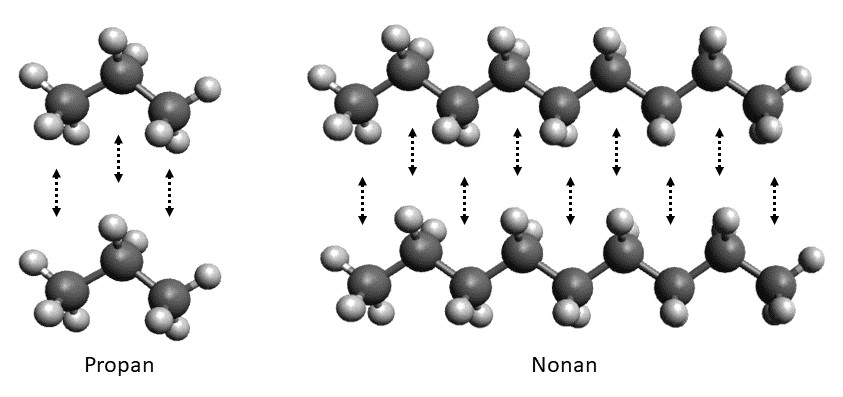
Hier kann man sehen, dass sich zwischen Propan-Molekülen wesentlich weniger Van-der-Waals Kräfte (Schwarzer Pfeil) ausbilden als zwischen Nonan-Molekülen.
Iso-Alkane haben generell eine niedrigere Schmelz- und Siedetemperatur, da die Ketten welche Van-der-Waals-Kräfte ausbilden können kürzer sind.
Die Löslichkeit
Alkane sind lipophil aber hydrophob, d.h. sie sind fettlöslich, aber nicht wasserlöslich. Das liegt daran, dass Wasser polar ist, während alle Alkane unpolar sind.
Alkane sind also nicht in Wasser löslich, aber beispielsweise in Benzin.
Chemische Eigenschaften
Alkane reagieren kaum mit anderen Stoffen, das erklärt auch warum Alkane im Erdöl seit Millionen von Jahren unverändert vorliegen.
Um Alkane zum reagieren zu bringen, braucht man sogenannte Radikale. Radikale besitzen ein ungepaartes Valenzelektron, wodurch sie extrem instabil und dadurch auch sehr reaktiv sind.
Eine dieser Reaktionen ist die Radikalische Substitution.
Eine wichtige Reaktion, welche mit Alkanen stattfindet, ist das Cracken. Dabei werden langkettige Alkane zu kurzkettigen gespalten, um so Benzin und Diesel herstellen zu können.
