Bestimme die Oxidationszahlen der folgenden Moleküle.
Bestimme die Oxidationszahl von Eisen in und .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmung von Oxidationszahlen
Bei Ionen, wie z.B. , entspricht die Oxidationszahl der Gesamtladung des Ions. Wir erhalten also eine Oxidationszahl von +2.
Sauerstoff hat die Oxidationszahl -2. Da die Summe der Oxidationszahlen innerhalb eines Moleküls dessen Gesamtladung (in unserem Fall ) entspricht, erhalten wir folgende Gleichung:
Die Oxidationszahl von Eisen in ist also +3.
Hast du eine Frage oder Feedback?
Atome in ihrer elementaren Form haben immer die Oxidationszahl 0. Folglich hat elementares Eisen eine Oxidationszahl von 0.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
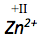
Das zweifach positiv geladene Zink-Ion erhält die Oxidationszahl +II.
Hast du eine Frage oder Feedback?
Die Oxidationszahl eines Ions entspricht immer dessen Ladung.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
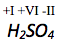
Die Oxidationszahl von Sauerstoff beträgt -II, von Wasserstoff -I. Die Summe der Oxidationszahlen des Moleküls muss 0 betragen, da es nicht geladen ist.
Die Oxidationszahl von Schwefel lässt sich wie folgt berechnen:
Hast du eine Frage oder Feedback?
Die Oxidationszahl von Sauerstoff in einer Verbindung beträgt immer -II, die von Wasserstoff immer +I. Die Summe der Oxidationszahlen muss in einem Molekül immer dessen Ladung entsprechen.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmung von Oxidationszahlen
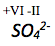
Die Oxidationszahl von Sauerstoff beträgt -II. Die Summe der Oxidationszahlen des Moleküls muss -2 betragen, da es zweifach negativ geladen ist.
Die Oxidationszahl von Schwefel lässt sich wie folgt berechnen:
Die Oxidationszahl von Schwefel lässt sich wie folgt berechnen:
Hast du eine Frage oder Feedback?
Die Oxidationszahl von Sauerstoff in einer Verbindung beträgt immer -II. Die Summe der Oxidationszahlen muss in einem Molekül immer dessen Ladung entsprechen.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
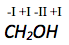
Die Oxidationszahl von Sauerstoff beträgt -II, von Wasserstoff -I. Die Summe der Oxidationszahlen des Moleküls muss 0 betragen, da es nicht geladen ist.
Die Oxidationszahl von Kohlenstof lässt sich wie folgt berechnen:
Hast du eine Frage oder Feedback?
Die Oxidationszahl von Sauerstoff in einer Verbindung beträgt immer -II. Die Summe der Oxidationszahlen muss in einem Molekül immer dessen Ladung entsprechen.
Dieses Werk steht unter der freien Lizenz
CC BY-SA 4.0 → Was bedeutet das?
