Die Elektrophile Addition ist eine Additionsreaktion, bei welcher Halogenen oder ähnlichen Verbindungen an ungesättigte Kohlenwasserstoffe (Alkene, Alkine) addiert werden.
Die Elektrophile Addition findet durch einen Angriff eines elektronenliebenden Teilchens, das Elektrophil, an der Doppel- oder Dreifachbindung statt.
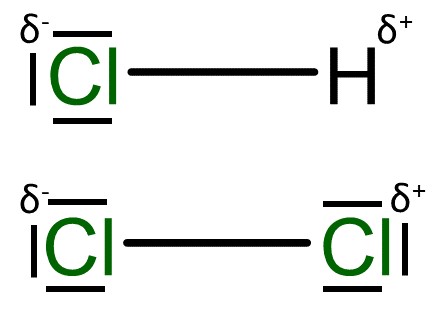
Elektrophil
Ein Elektrophil oder auch elektronenliebendes Teilchen, besitzt üblicherweise eine positive () und eine negative Teilladung ().
An der positiven Teilladung herrscht eine Elektronenmangel, deshalb wird das Teilchen von elektronenreichen Mehrfachbindungen angezogen.
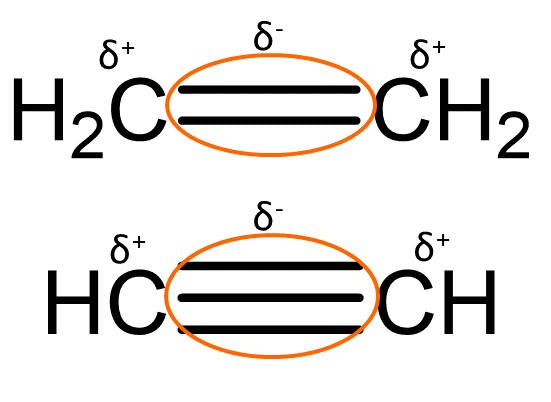
Elektronenreiche Mehrfachbindung
Mehrfachbindungen besitzen sehr viele Elektronen, sie besitzen eine negative Teilladung ().
Elektrophile können deshalb an der Mehrfachbindung angreifen.
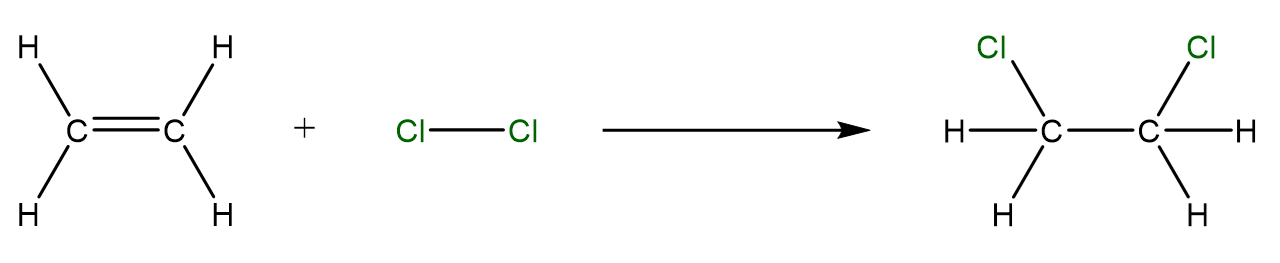
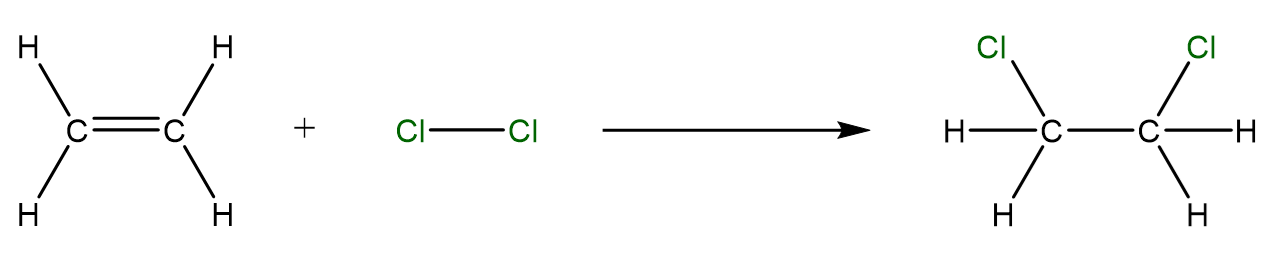
Elektrophile Addition von einem Halogen an ein Alken
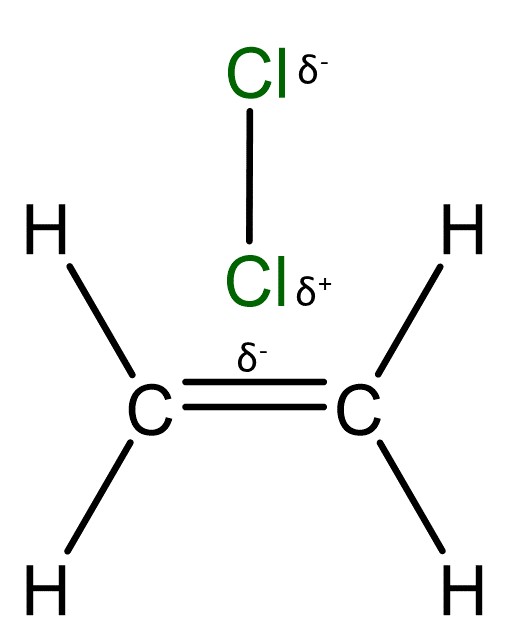
Die Elektrophile Addition wird hier anhand der Reaktion von Chlor () an Ethen () dargestellt.
Polarisierung
Ein Chlormolekül () wird durch die elektronenreiche Doppelbindungen eines Ethenmoleküls () polarisiert. Das heißt, dass bindende Elektronenpaar im Chlormolekül wird so verschoben, dass Teilladungen entstehen.
Elektrophiler Angriff
Die positive Teilladung des Chlormoleküls greift die Doppelbindung in einem elektrophilen Angriff an. Dabei entsteht ein positiv geladenes Ethen-Chlor-Ion und ein negativ geladenes Chlor-Ion.
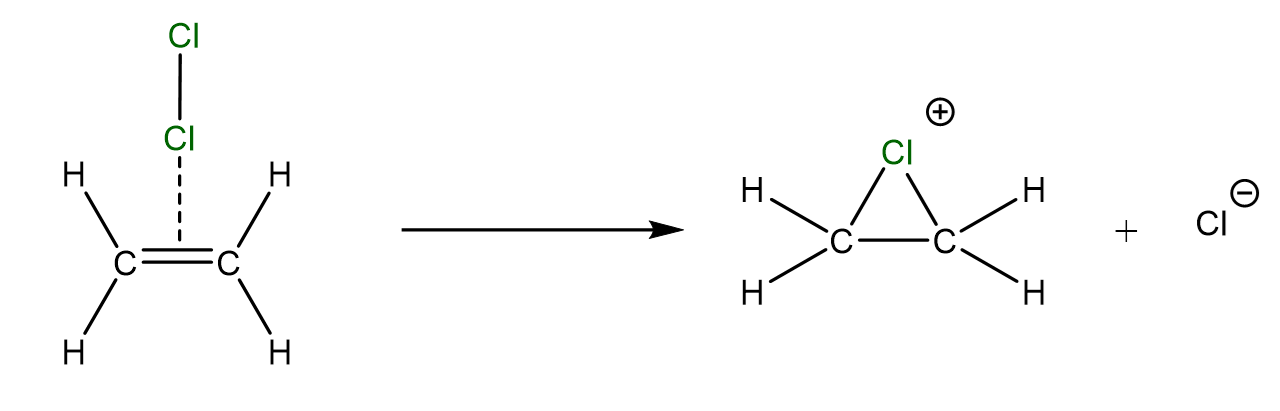
Die Zyklische Zwischenstufe des Ethen-Chlor-Ions ist sehr instabil und reagiert fast direkt weiter.
Nukleophiler Angriff
Das negativ geladene Chlor-Ion greift in einem Nukleophilen Angriff die ehemalige Doppelbindung an.
Da das Ethen nun eine positive Ladung hat, also einen Elektronenmangel, kann das Chlor-Ion mit Elektronenüberschuss hier angreifen.
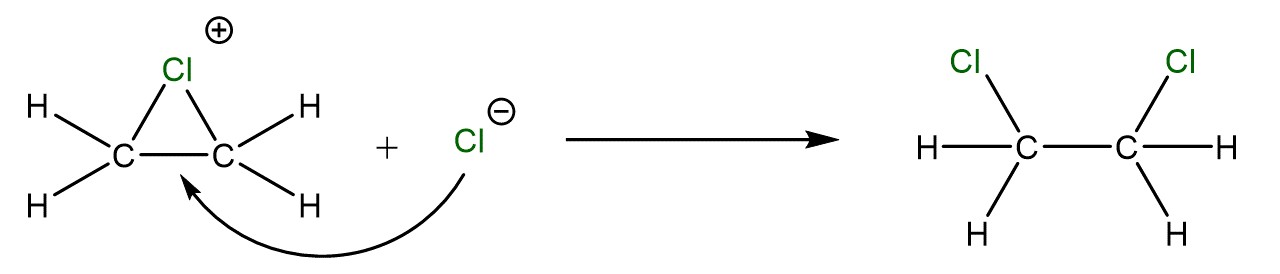
Dabei entsteht unser Produkt: 1,2-Dichlorethan.
