Alkene sind in der freien Natur vorkommende Kohlenwasserstoffbindungen. Diese bestehen aus C- und H-Atomen. Im Gegensatz zu Alkanen bestehen hier zwischen den C-Atomen nicht nur Einfach-, sondern auch Doppelbindungen.
Alkene gehören zur Gruppe der ungesättigten Kohlenwasserstoffen.
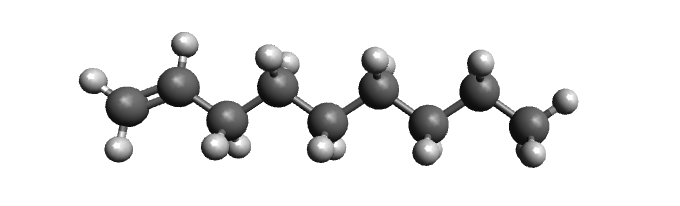
Hier ist das Alken "Non-1-en" abgebildet. Die Summenformel von Non-1-en ist .
Vorkommen
Alkene kommen in geringen Mengen im Erdöl vor, außerdem sind sie in Pheromonen enthalten. Pheromone sind Botenstoffe zur Signalübertragung zwischen Individuen.
Die homologe Reihe der Alkene
Die allgemeine Summenformel der nicht-verzweigten Alkene mit einer Doppelbindung lautet . Methan ist eine Ausnahme, da es hier keine Bindungen zwischen C-Atomen gibt, gibt es auch kein Methen.
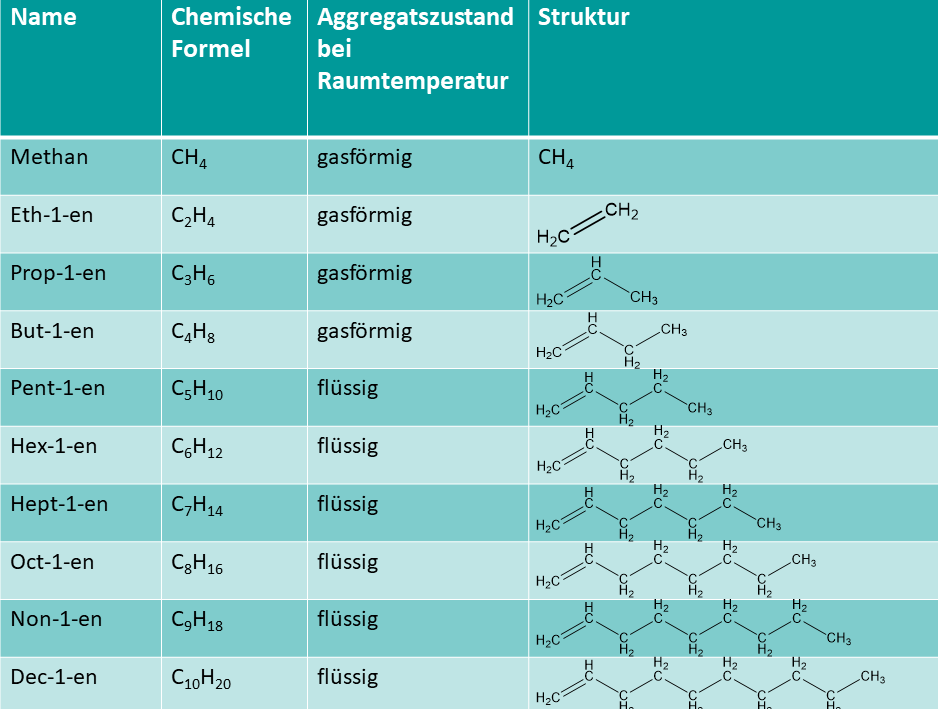
Alle Alkene ab 15 C-Atomen liegen als Feststoff vor.
Cycloalkene
In chemischen Eigenschaften und Reaktionsverhalten gibt es zwischen Cycloalkenen und Alkenen kaum Unterschiede. Doch durch die ringförmige Struktur (cyclo) weisen diese einige Besonderheiten auf.
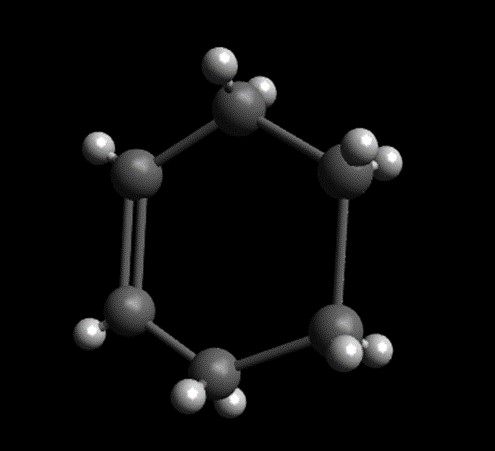
Hier ist das Cycloalken Cyclohexenabgebildet, die Summenformel ist .
Das kleinste Cycloalken ist Cyclopropen. Da die Bindungen im Cyclopropen so nahe beieinander stehen, steht das Molekül stark unter Spannung. Dementsprechend ist es sehr reaktiv.
Alkylsubstituierte Cycloalkene sind nicht nicht nur in der Theorie oder im Labor zu finden, sondern treten auch in der Natur auf. Terpene und Steroide sind zwei wichtige Beispiele für diese.
Eigenschaften von Alkenen
Da die Doppelbindungen der Alkene sehr reaktiv sind, gelten sie als wichtiger Ausgangsstoff für viele andere Grundstoffe der chemischen Industrie.
Siede- und Schmelztemperaturen
Ähnlich wie bei den Alkanen steigen die Siede- und Schmelztemperaturen innerhalb der homologen Reihe der Alkene. Hier hängt die Siedetemperatur außerdem von der Anzahl der Doppelbindungen ab. Je mehr Doppelbindungen in der Verbindung sind, desto niedriger sind die Siedetemperaturen.
Löslichkeit
Alkene lösen sich genau wie Alkane sehr gut in unpolaren Lösungsmitteln oder Fetten. Sie sind lipophil. Außerdem sind Alkene auch Hydrophob, allerdings lösen sie sich in geringen Mengen in Wasser.
Beispiele von Alkenen
Das Ethen wird in der Lebensmittelindustrie zum Nachreifen von Obst verwendet. Außerdem benutzt man es zur Herstellung von Kunststoffen, Klebstoffen und Lösungsmitteln. Zuletzt wird Ethen noch in der Pharmaindustrie eingesetzt.
Propen hingegen findet Verwendung als Brenngas (Flüssiggas) und in der Benzin- sowie Kunststoffherstellung.
Buten wird benötigt um Kunststoff und Synthesekautschuk herzustellen.
Chemische Reaktionen
Eine wichtige Reaktion der Alkene ist die Elektrophile Addition.
