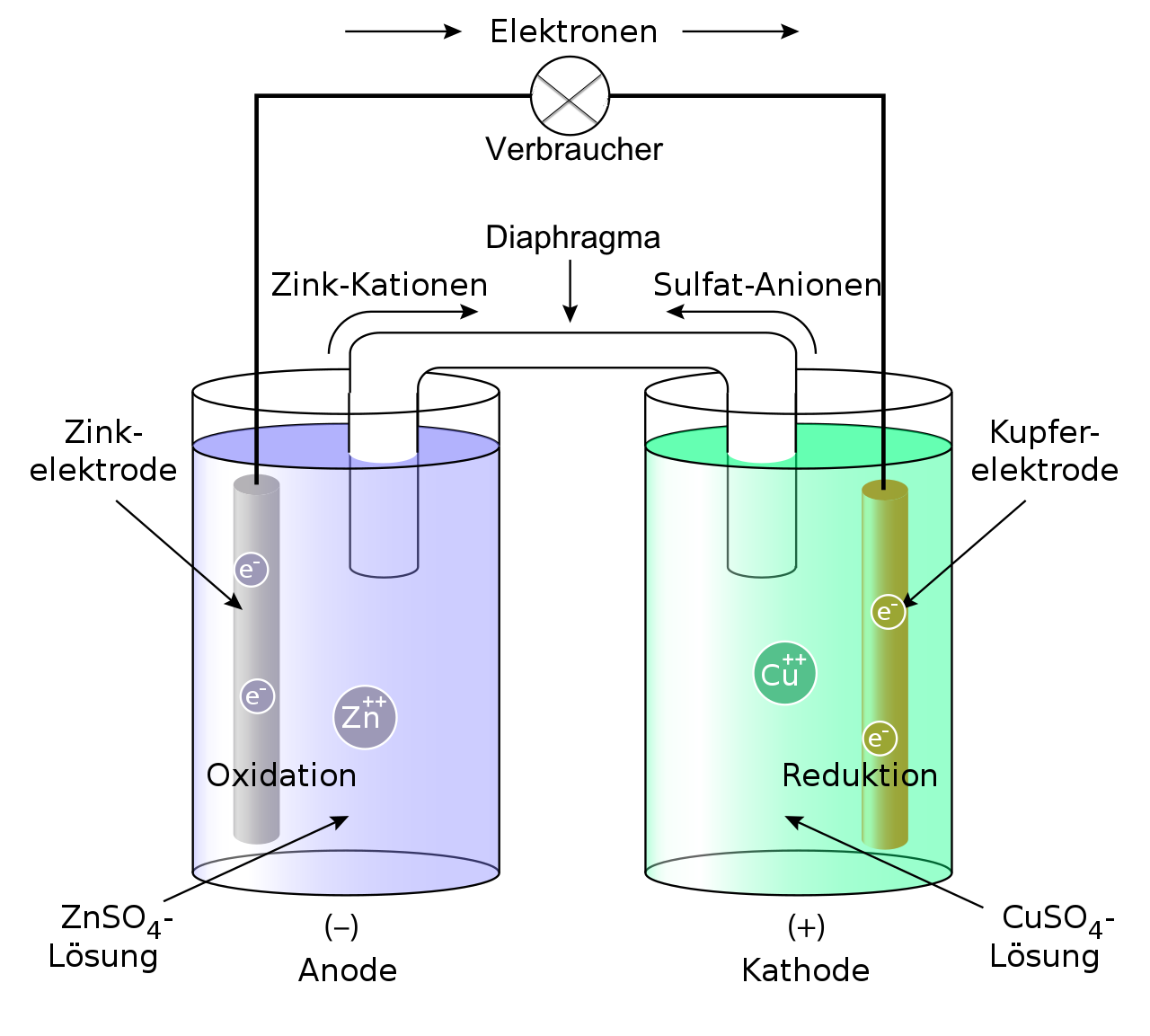
Bereits 1836 entwickelte John Frederic Daniell eine Batterie, die Strom liefert. Der Grundaufbau dieser Batterie heißt seitdem Daniell-Element (→ Abb. 1). Die Erfindung beruht auf einer Redoxreaktion von Zink / Zink-Ionen und Kupfer /Kupfer-Ionen, die freiwillig ohne Energiezufuhr abläuft:
Abb 1. - CC BY 3.0 Rehua (verändert)
Im Daniell-Element wird chemische Energie in elektrische Energie umgewandelt. Oxidation und Reduktion müssen getrennt ablaufen, damit Strom fließt. Sie sind nur durch ein Diaphragma miteinander verbunden, damit die Zink- und Sulfat-Ionen wandern können.
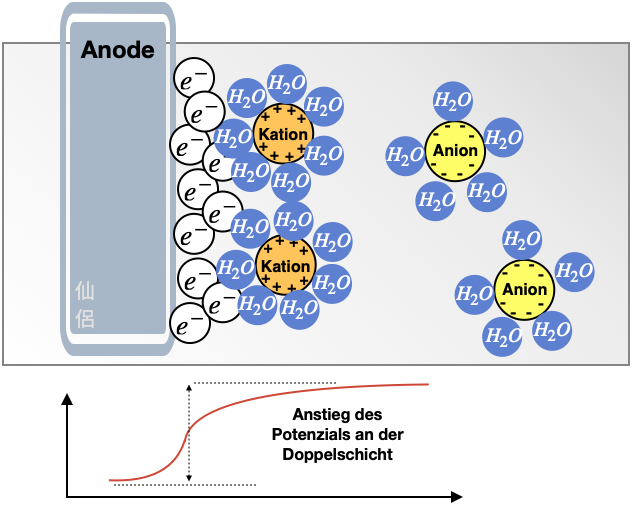
Die entgegengesetzten Ladungen an der Phasengrenze jeder Elektrode führen zu einem elektrischen Feld und damit zur Ausbildung des elektrochemischen Potenzials E (→ Abb. 2):
Abb 2. Das elektrochemische Potenzial, eigenes Werk, CC BY Sien-Lie Saleh
An der Anode und der Kathode ist das elektrochemische Potenzial jeweils unterschiedlich. Dadurch entsteht eine messbare Differenz der Potenziale an den Elektroden.
Beim Daniell-Element entsteht daher eine Zellspannung von ca. 1 V. Damit kann z. B. ein Propeller oder eine Glühbirne betrieben werden. Das Diaphragma sorgt für den Ladungsausgleich im Elektrolyt.
Gesamtreaktion des Daniell-Elements:
⊖ Oxidation (Anode): | |
|---|---|
Donator-Halbzelle | |
⊕ Reduktion (Kathode) | |
Akzeptor-Halbzelle | |
Redoxreaktion: |
Bei einer Anordnung wie beim Daniell-Element, das aus zwei Halbzellen besteht, spricht man von einer galvanischen Zelle oder dem galvanischen Element. Nicht wieder aufladbare galvanische Zellen werden als Primärelement bezeichnet.
Batterien sind elektrochemische Primärelemente, die als Energiespeicher dienen. Die freiwillige Gesamtreaktion läuft nur in eine Richtung und ist nicht umkehrbar. Deshalb sind Batterien nicht wieder aufladbar.
Bezug zur Lebenswelt
Alkali-Mangan-Batterien
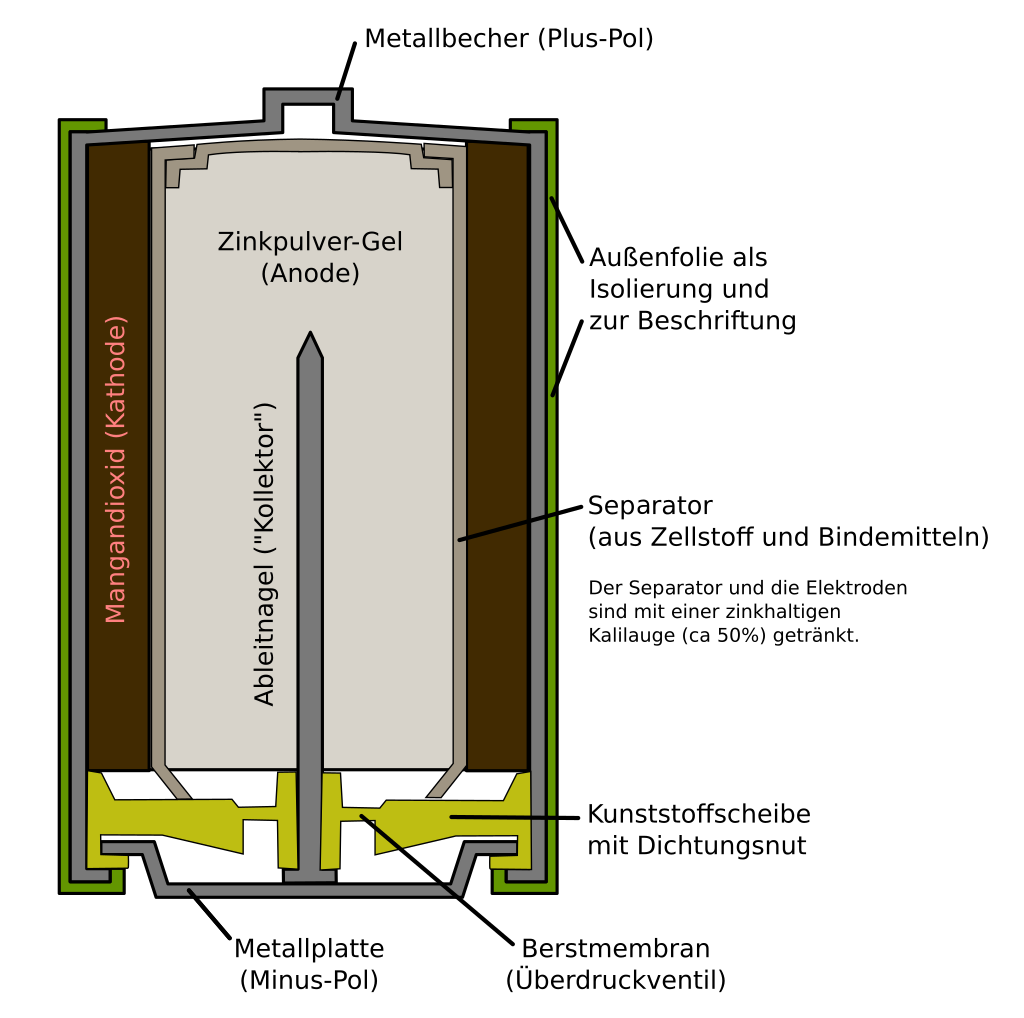
Heute werden hauptsächlich Alkali-Mangan-Batterien als Einwegbatterien genutzt (→ Abb. 3).
Die Anode besteht aus Zinkpulver und die Kathode aus Mangandioxid. Der Aufbau ist anders als im Daniell-Element, da die Halbzellen ineinander verschachtelt sind. Der obere Stahlmantel dient als Plus-Pol. Ein Nagel, der mit der unteren Metallplatte verbunden ist, dient als Minus-Pol. Die Elektronen wandern über eine Metallverbindung zum Verbraucher.
by Tympanus, in Wikipedia.org
Alkali-Mangan-Batterien kommen- je nach Anwendung - in unterschiedlichen Bauformen vor: Als Knopfzelle, 9V-Block oder klassische zylinderförmige Batterie (→ Abb. 4):

Abb 4: Verschiedene Bauformen vonAlkali-Mangan-Batterien, eigenes Werk, CC BY Sien-Lie Saleh
Um auch international mit standardisierten Potenzialen zu arbeiten, hat man als Bezugselektrode die Standard-Wasserstoffelektrode gewählt. Damit ist es möglich, die Potenzialdifferenz verschiedener Metalle im Voraus zu berechnen.
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema: