Die Silberspiegelprobe, auch Tollensprobe genannt, ist ein Nachweisreaktion für Aldehyde () oder reduzierenden Stoffe. Dabei bildet sich eine dünne Schicht von Silber, daher der Name Silberspiegelprobe.
Ablauf der Reaktion
Die Tollensreagenz besteht aus einer Silbernitratlösung in einem alkalischen Milieu. Diese Reagenz wird in die Lösung der nachzuweisenden Substanz gegeben. Danach wird diese kurz erwärmt (auf 70°C).
Der Nachweis ist dann positiv, wenn elementares Silber ausfällt und sich an der Reagenzglaswand anlagert.

Hier sieht man die gebildete Silberschicht
Reaktionsgleichung
Bei der Silberspiegelprobe handelt es sich um eine RedOx-Reaktion. Um die korrekte Gleichung aufzustellen hilft es zuerst die Summenformel niederzuschreiben.
Danach müssen die Oxidationszahlen bestimmt werden.
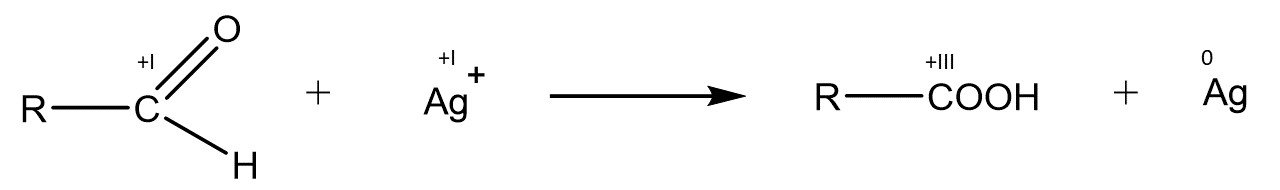
Jetzt können die übertragenen Elektronen eingezeichnet werden.
Nun müssen die Ladungen ausgeglichen werden, da die Reaktion im alkalischen Milieu stattfindet. Alkalisches Milieu oder auch basisches Milieu beduetet das der Ausgleich mit -Ionen stattfindet.
Anschließend muss ein Stoffausgleich stattfinden, damit auf beiden Seiten der Reaktionsgleichung dieselben Elemente stehen.
Zuletzt müssen die Elektronen ausgeglichen werden und die Gesamtgleichung kann formuliert werden.
Die GLeichung kann nun gekürzt werden damit wir die ausgeglichene Reaktionsgleichung erhalten.
Bildquelle:
Wikimedia Commons (Tmv23)
