Anfang des 19. Jahrhunderts entdeckten Chemiker, dass sich bestimmte Eigenschaften von Elementen periodisch wiederholten. Dmitri Mendelejew entwickelte aufgrund dieser Erkenntnis unser heutiges Periodensystem.
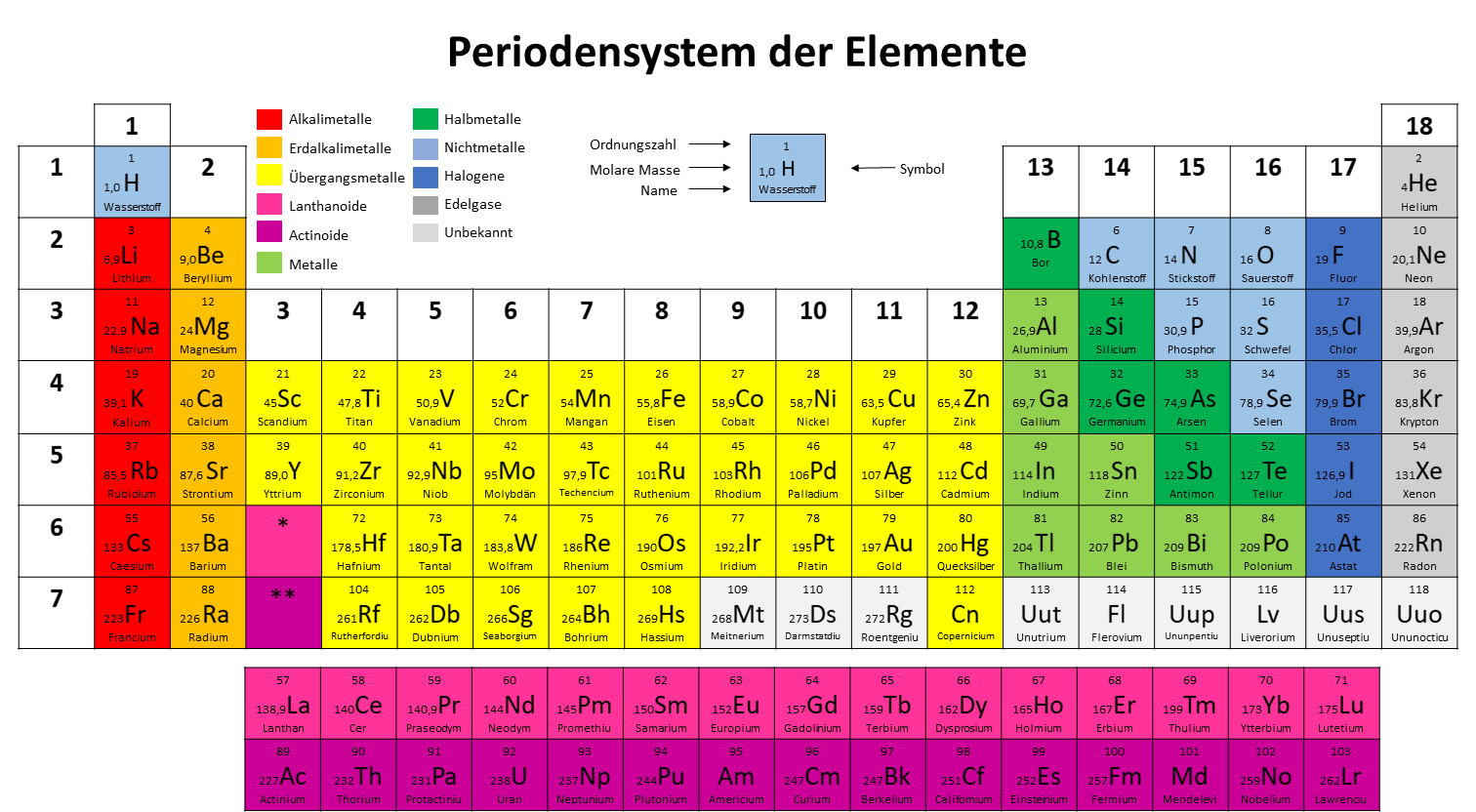
Um das Periodensystem besser zu verstehen, solltest du dir die einzelnen Elemente etwas genauer anschauen.
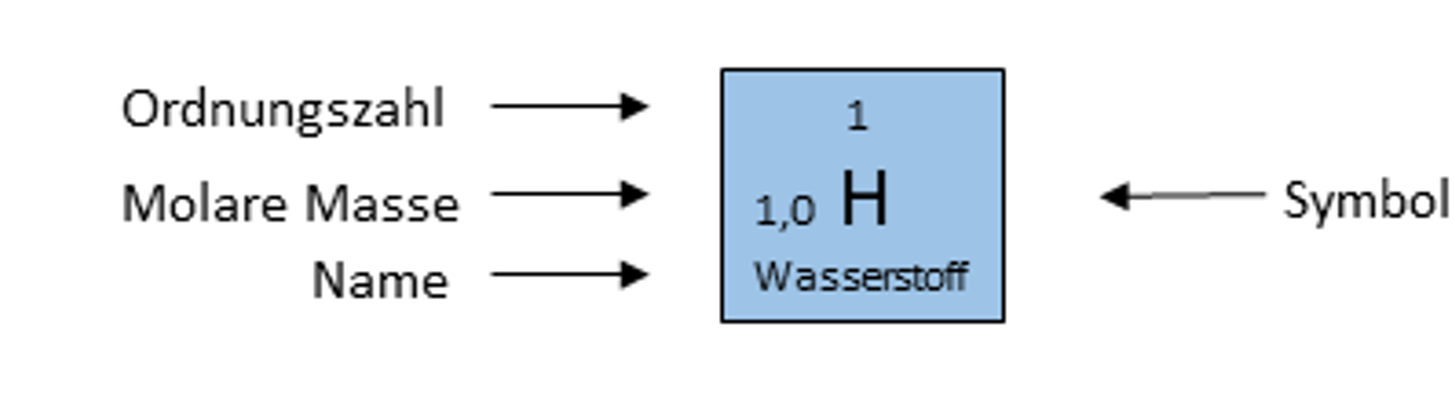
Du siehst hier das Element Wasserstoff. Neben dem Namen des Elements sind immer noch mindestens drei weitere Informationen angegeben. Nämlich das Elementsymbol, die molare Masse und die Ordnungszahl.
Elementsymbol
Jedes Element hat neben seinem Namen auch noch eine Abkürzung, die beispielsweise in Reaktionsgleichungen oder Strukturformeln verwendet wird. In unserem Beispiel steht das H für das Element Wasserstoff. Dieses Symbol macht es möglich, dass nicht immer der komplette Name ausgeschrieben werden muss. Außerdem sind sie international verständlich und machen somit die chemische Sprache über Ländergrenzen hinweg verständlich.
Molare Masse
Die molare Masse wird oft auch Massenzahl genannt. Sie gibt an, wie schwer ein Atom eines bestimmten Elements ist. Vereinfacht gesagt, entspricht die Masse eines Atoms der Masse der enthaltenen Nukleonen, also Protonen und Neutronen zusammen. Angegeben wird die Masse in u ("unified atomic mass unit").
In dem Beispiel kannst du also aus dem Periodensystem ablesen, dass ein Atom des Elements Wasserstoff 1,0 u schwer ist.
Ordnungszahl
Die Ordnungszahl ist, wie der Name schon sagt, die Einheit, nach der die Elemente im Periodensystem angeordnet sind. Denn wenn du dir das Periodensystem anschaust, siehst du, dass die Ordnungszahl der Elemente von links nach rechts und von oben nach unten zunimmt.
Die Ordnungszahl wird auch oft Protonenzahl oder Kernladungszahl genannt, denn sie entspricht der Anzahl der Protonen eines Atoms.
In dem Beispiel kannst du also ablesen, dass ein Atom des Elements Wasserstoff ein Proton im Kern besitzt. Da das die kleinste Ordnungszahl ist, findest du den Wasserstoff oben links im Periodensystem.
Sortierung der Elemente im Periodensystem
Die Elemente sind im Periodensystem in Gruppen (=Spalten) und in Perioden (=Zeilen) eingeteilt.
Diese Einteilung ist dadurch entstanden, dass festgestellt wurde, dass sich bestimmte Eigenschaften von Elementen wiederholen, wenn man sie nach der Ordnungszahl sortiert. Alle Elemente mit ähnlichen Eigenschaften wurden untereinander geschrieben. So entstanden die Gruppen und Perioden.
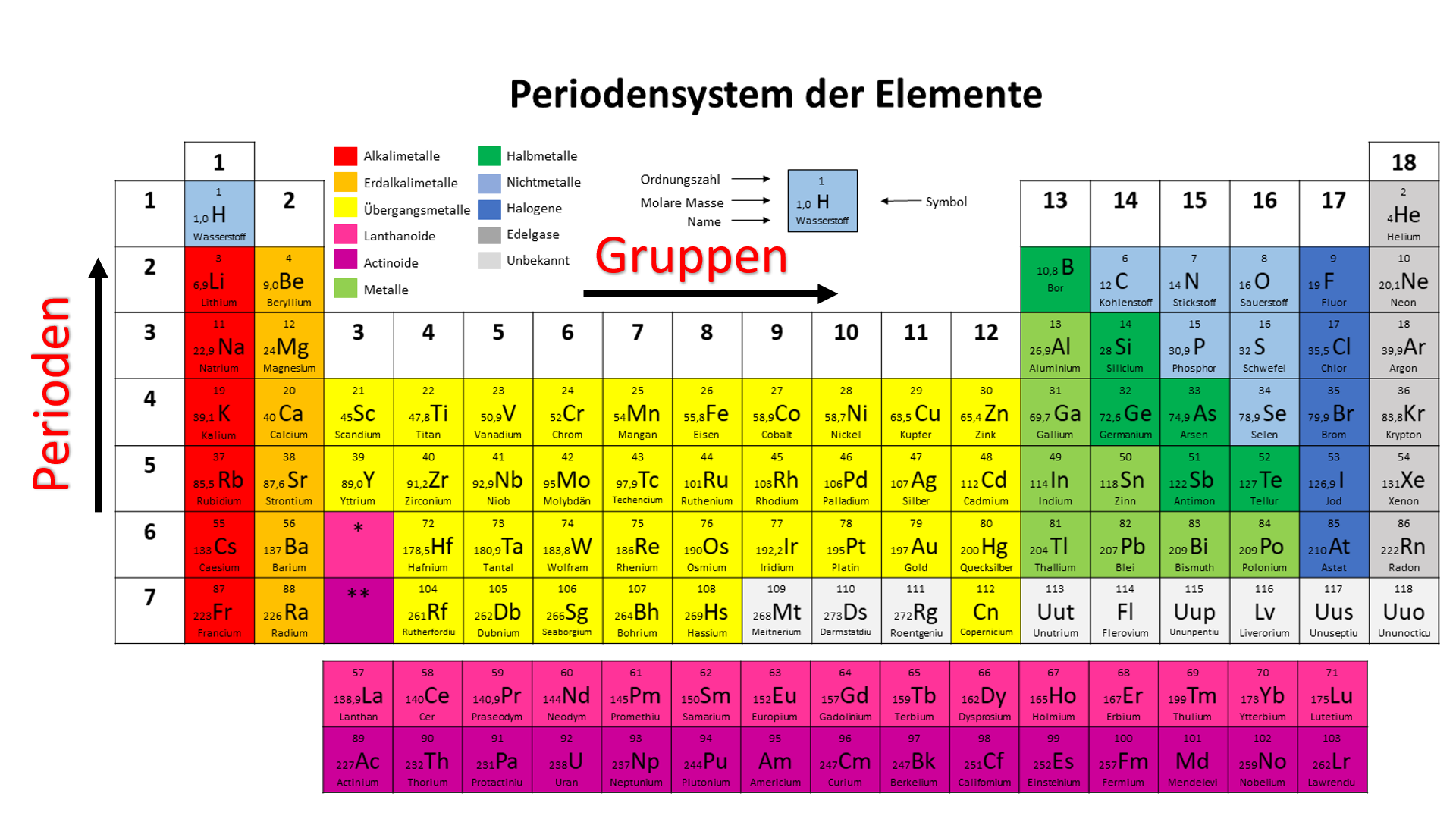
Periodenzahl
Die Eigenschaften der Elemente wiederholen sich periodisch. Daher kommt auch der Name des Periodensystems.
Die Periodenzahl entspricht der Anzahl der Schalen im Bohr´schen Atommodell oder die der Hauptquantenzahl im Orbitalmodell.
Gruppenzahl
Die Gruppenzahl entspricht der Anzahl der Außenelektronen (=Valenzelektronen) eines Atoms. Diese sind auch dafür verantwortlich, dass in einer Gruppe immer die Elemente zusammengefasst sind, die ähnliche chemische Eigenschaften besitzen.
So haben beispielsweise Wasserstoff, Lithium, Natrium, Kalium, Rubidium, Caesium und Francium alle ein Valenzelektron und sind somit in der ersten Gruppe zu finden.
Dir Gruppen sind noch einmal in Hauptgruppen (Gruppe 1, 2, 13, 14, 15, 16, 17 und 18) und Nebengruppen unterteilt.
Die Hauptgruppenelemente werden wie folgt bezeichnet:
Hauptgruppe: Alkalimetalle
Hauptgruppe: Erdalkalimetalle
Hauptgruppe: Borgruppe/Erdmetalle/Triele
Hauptgruppe: Kohlenstoffgruppe/Tetrele
Hauptgruppe: Stickstoffgruppe/Pentele/Pnicogene
Hauptgruppe: Sauerstoffgruppe/Chalkogene
Hauptgruppe: Halogene
Hauptgruppe: Edelgase
Du hast noch nicht genug vom Thema?
Hier findest du noch weitere passende Inhalte zum Thema:
