Kohlenwasserstoffe sind eine wichtige Gruppe chemischer Verbindungen aus der organischen Chemie.
Kohlenwasserstoffe bestehen, wie der Name schon sagt, ausschließlich aus Kohlenstoff- und Wasserstoffatomen.
Sie sind sehr vielfältig und teilen sich in vier Untergruppen, den Alkanen, Alkenen, Alkinen und Aromaten.
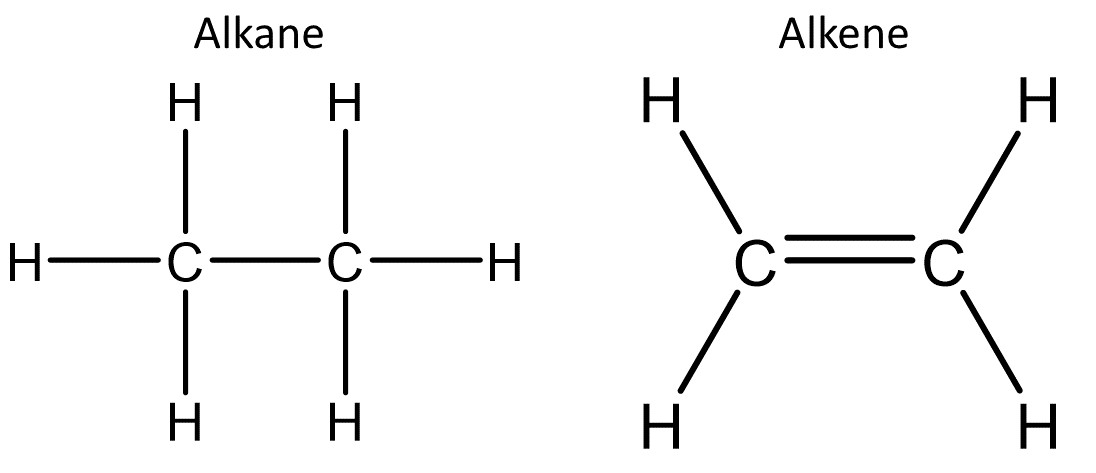
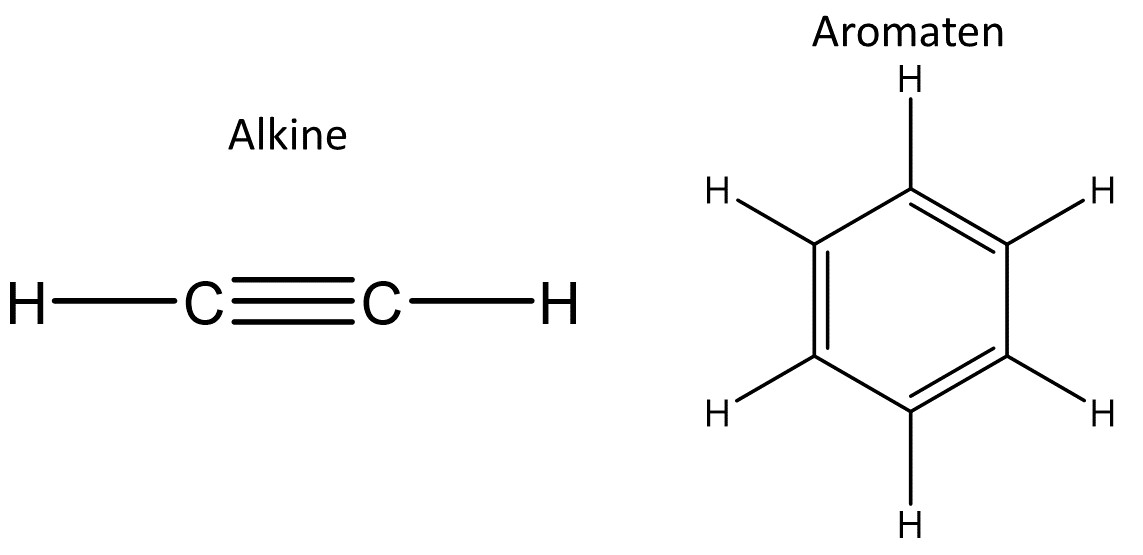
Vorkommen
Die meisten Kohlenwasserstoffe kommen insbesondere im Erdöl und Erdgas vor. In geringen Mengen kommen sie außerdem in Pflanzen vor.
Verwendung
Kohlenwasserstoffe werden zum Großteil als fossile Brennstoffe verwendet, wodurch sie eine große technische und wirtschaftliche Bedeutung haben.
Daneben dienen sie außerdem der Synthese vieler organischer Stoffe.
