1 Übersicht
Inhalt des Kurses
RedOx-Reaktionen kommen in allen Bereichen der Chemie vor. Dieser Kurs beschäftigt sich vertieft mit dem Thema RedOx-Reaktionen. Anhand des Schemas zur Lösung von RedOx-Reaktionen werden die einzelnen Schritte vertieft behandelt. Zum Teil gibt es zusätzlich auch Übungsaufgaben, um Teilschritte noch einmal zu wiederholen.
Schema
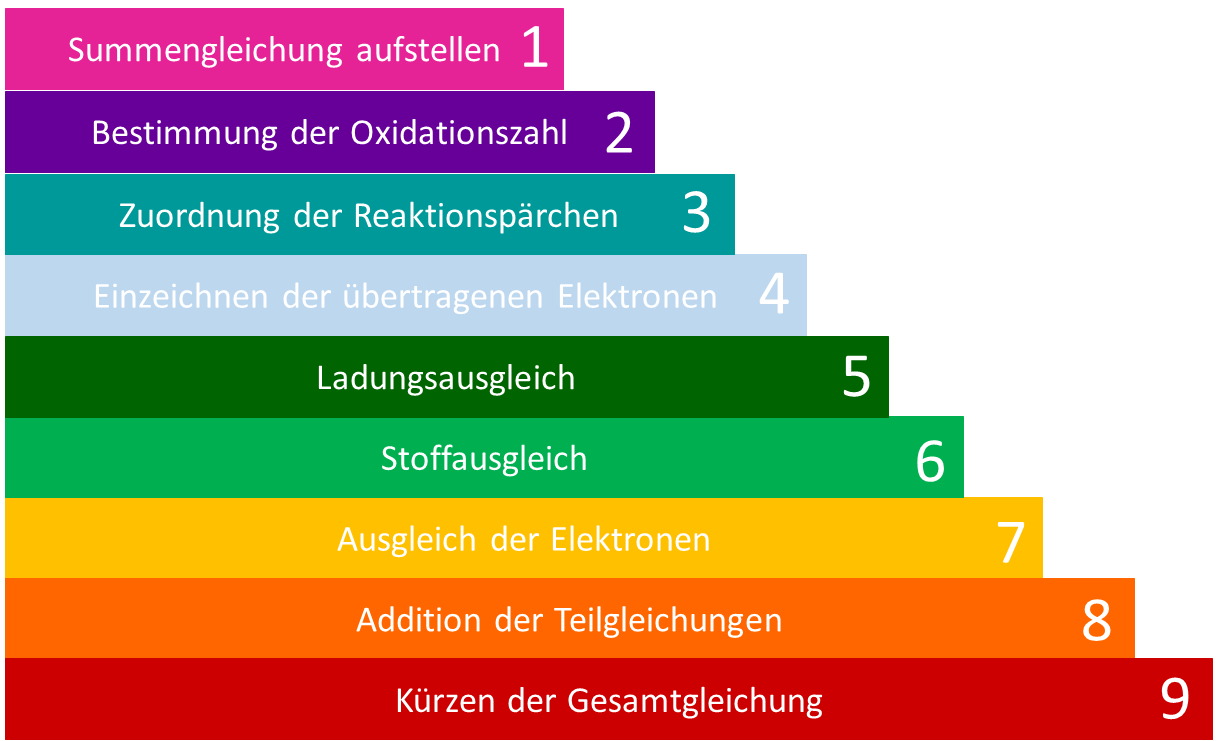
Vorkenntnisse
Aufstellen von Reaktionsgleichungen
Ausgleichen von Reaktionsgleichungen
Kursdauer
ca. 1 Stunde
2 Einführung
RedOx-Reaktionen kommen fast überall vor, sie finden in unserem Körper beim Stoffwechsel statt, bei Verbrennungen in der technischen Produktion und noch in vielen mehr.
Wie kommt das Funkeln ins Feuerwerk?
Sicherlich hast auch du bereits einmal an Silvester eine Rakete in die Höhe steigen lassen und die funkelnde Farbenpracht bestaunt. Vielleicht hast du dir dabei auch die Frage gestellt, wie diese Feuerwerkseffekte überhaupt entstehen.
Dabei sind die erstaunliche Farbpracht und das Funkeln nichts anderes als ein Ablauf verschiedener Redoxreaktionen.
Wie dieser Vorgang genau funktioniert, erarbeiten wir in diesem Kurs gemeinsam.

Feuerwerk - Funkelnde Redoxreaktionen
3 Donator-Akzeptor-Prinzip
Die Grundlage für RedOx-Reaktionen ist das Donator-Akzeptor-Prinzip. Dieses kennt ihr bereits von Säure-Base Reaktionen. Wenn ihr dennoch eine kurze Wiederholung wollt, ist diese Seite das Richtige für euch.
Bei dem Donator-Akzeptor-Prinzip handelt es sich um ein wichtiges Prinzip aus der Chemie. Die Grundlage des Prinzips ist es, dass in einer Reaktion ein Teilchen (Proton, Elektron, etc.) von einem Reaktionsteilnehmer (Donator) auf den anderen (Akzeptor) übertragen wird.
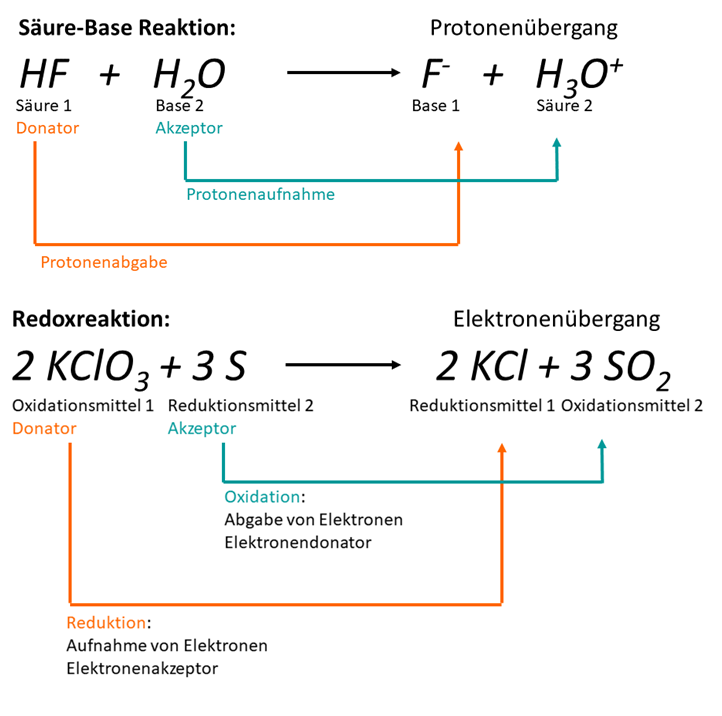
In der folgenden Graphik wird das Prinzip auf Säure-Base und auf RedOx-Reaktionen angewandt.
Hier kann man erkennen, dass bei der Säure-Base Reaktion ein Proton () von der Säure 1 an die Base 2 abgegeben wird. Die Elektronen, welche bei der RedOx-Reaktion vom Schwefel zum Kaliumchlorat wechseln, sind in dieser Darstellung nicht zu sehen. Wie man den Wechsel trotzdem veranschaulichen kann, lernst du in den nächsten Seiten.
Schaubild Donator-Akzeptor-Prinzip
Ohne das Donator-Akzeptor-Prinzip wäre eine Redoxreaktion gar nicht erst möglich, da eine Redoxreaktion einen Elektronenübergang darstellt. Es braucht sozusagen ein "geben und nehmen" zwischen den Atomen der RedOx-Teilnehmer, da jedes für seinen energetisch stabilsten Zustand ein Elektronenoktett in seiner Elektronenkonfiguration anstrebt.
Diese Art der Reaktion kommt also, wie die meisten chemischen Reaktionen, nur zustande, weil alle Reaktionsteilnehmer ihren Edelgaszustand (Elektronenoktett) anstreben.
4 Was ist eigentlich eine RedOx-Reaktion
Eine RedOx-Reaktion setzt sich zusammen aus einer Reduktion und einer Oxidation.
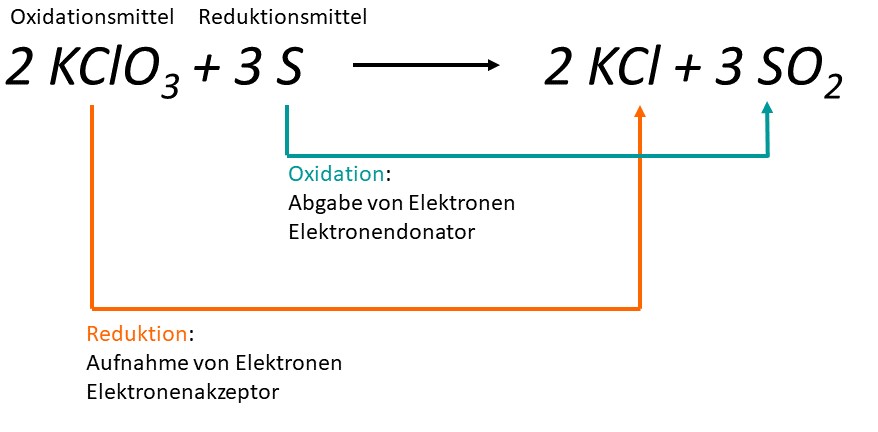
Das Grundprinzip einer RedOx-Reaktion ist der Elektronenübergang zwischen den Reaktionsteilnehmern (Atome/ Moleküle/ Ionen). Dabei werden Elektronen während der Oxidation abgegeben und im Laufe der Reduktion aufgenommen. Eine der RedOx-Reaktionen im Feuerwerk ist beispielsweise die folgende. Dabei wird Kaliumchlorat () zu Kaliumchlorid () reduziert, es nimmt also Elektronen auf. Während Schwefel () zu Schwefeldioxid () oxidiert wird, es gibt also Elektronen ab.
Der Reaktionsteilnehmer welcher Elektronen abgibt (oxidiert wird) wird auch Donator genannt. Der andere, welcher Elektronen aufnimmt (reduziert wird) wird dementsprechend Akzeptor genannt. Das Prinzip kennen wir bereits von dem Donator-Akzeptor-Prinzip.
Die Reaktionsteilnehmer nennt man übrigens Reduktionsmittel (Donator) und Oxidationsmittel (Akzeptor). Bei dem Reduktionsmittel handelt es sich um den Teilnehmer welche oxidiert wird und dadurch natürlich den anderen reduziert. Das Oxidationsmittel ist im Gegensatz dazu der Teilnehmer, welcher selber reduziert wird und damit den anderen oxidiert.
Früher dachte man übrigens, dass bei allen RedOx-Reaktionen Sauerstoff () von einem Reaktionsteilnehmer an den anderen abgegeben wird. Wenn man sich die obenstehende Reaktionsgleichung anschaut, ist das auch einleuchtend und richtig.
Allerdings weiß man mittlerweile, dass es auch RedOx-Reaktionen gibt, welche ganz ohne Sauerstoff ablaufen.
5 Wie erkennt man eine RedOx-Reaktion?
Nun wissen wir also, dass bei einer RedOx-Reaktion immer ein Elektronenübergang stattfindet. Dabei wird ein Reaktionsteilnehmer reduziert und ein anderer oxidiert. Woran können wir aber nun erkennen, ob es sich um eine RedOx-Reaktion handelt? Dazu betrachten wir die Oxidationszahl der Reaktionsteilnehmer, die in manchen Büchern auch Oxidationsstufe genannt wird.
Aber was ist eine Oxidationszahl?
Bei der Oxidationszahl handelt es sich um eine Angabe zur Elektronendichte eines Atoms, oder Moleküls. Diese Elektronendichte und somit auch die Oxidationszahl ändert sich für jeden Reaktionsteilnehmer im Verlaufe einer RedOx-Reaktion.
Je höher die Elektronendichte, desto mehr negative Ladungen sind vorhanden. Dementsprechend ist die Oxidationszahl niedriger.
Je niedriger die Elektronendichte, desto weniger negative Ladungen sind vorhanden.
Dementsprechend ist die Oxidationszahl höher.
Bei einer Reduktion wird die Elektronendichte erhöht, wodurch die Oxidationszahl geringer wird.
Elemente mit hoher Elektronegativität ziehen Bindungselektronen eher an als Elemente mit niedriger Elektronegativität.
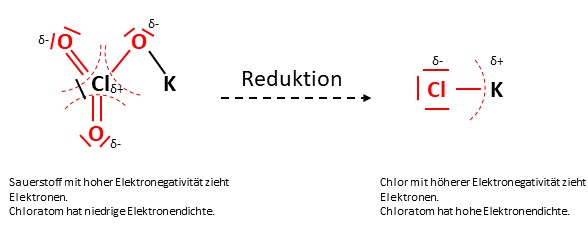
Bei der Oxidation wird die Elektronendichte geringer, weshalb die Oxidationszahl steigt.
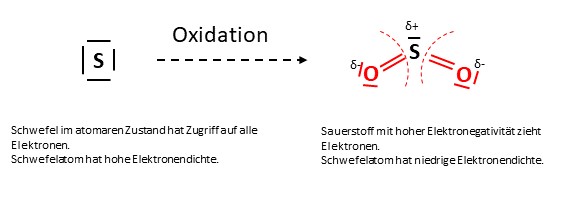
Eine RedOx-Reaktion ist also jede Reaktion, bei welcher sich die Oxidationszahl der Reaktionsteilnehmer verändert. Bei unserer RedOx-Reaktion aus dem Feuerwerk würde das dann wie folgt aussehen.
Die Oxidationszahl gibt man übrigens immer in Römischen Zahlen oberhalb des jeweiligen Stoffs an.
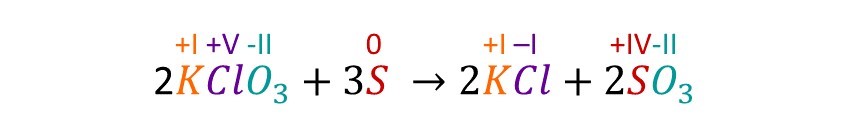
Bei der Veränderung der Oxidationszahl wird immer nur eines der Atome betrachtet, auch wenn es sich insgesamt um ein Molekül handelt. Deswegen wird hier nur die Veränderung des Chlor- und des Schwefelatoms betrachtet.
Nun wissen wir, was Oxidationszahlen sind, im nächsten Schritt lernen wir wie man diese bestimmen kann.
6 Bestimmen der Oxidationszahl
Nach der Aufstellung der Summengleichung ist der erste Schritt beim Lösen einer RedOx-Gleichung das Bestimmen der Oxidationszahl.
Dafür gibt es einige Regeln, mit deren Hilfe man nahezu alle Oxidationszahlen aller Atome/ Moleküle und Ionen bestimmen kann.
(1) Die Summe aller Oxidationszahlen eines Moleküls stimmt immer mit dessen Ladung überein. Ist das Molekül ungeladen, ist die Summe der Oxidationszahlen gleich 0.
(2) Die Oxidationszahl eines einfachen Ions entspricht der elektrischen Ladung.
(3) Sauerstoffatome in einer Verbindung besitzt immer die Oxidationszahl -II, außer in folgenden Fällen:
In Peroxiden ist die Oxidationszahl von Sauerstoffatomen immer -I.
In Verbindungen mit Fluoratomen ist sie immer +II.
(4) Wasserstoffatome in einer Verbindung besitzen immer die Oxidationszahl +I.
(5) Die Oxidationszahl von einatomig vorliegenden Elementen ist immer 0.
(6) Die Oxidationszahl von Metallen in Verbindung ist immer positiv und entspricht der Wertigkeit.
(7) Die Nummer der Hauptgruppe legt die höchstmögliche Oxidationszahl der sich in dieser Gruppe befindenden Atome fest.
7 Vertiefung: Oxidationszahlen
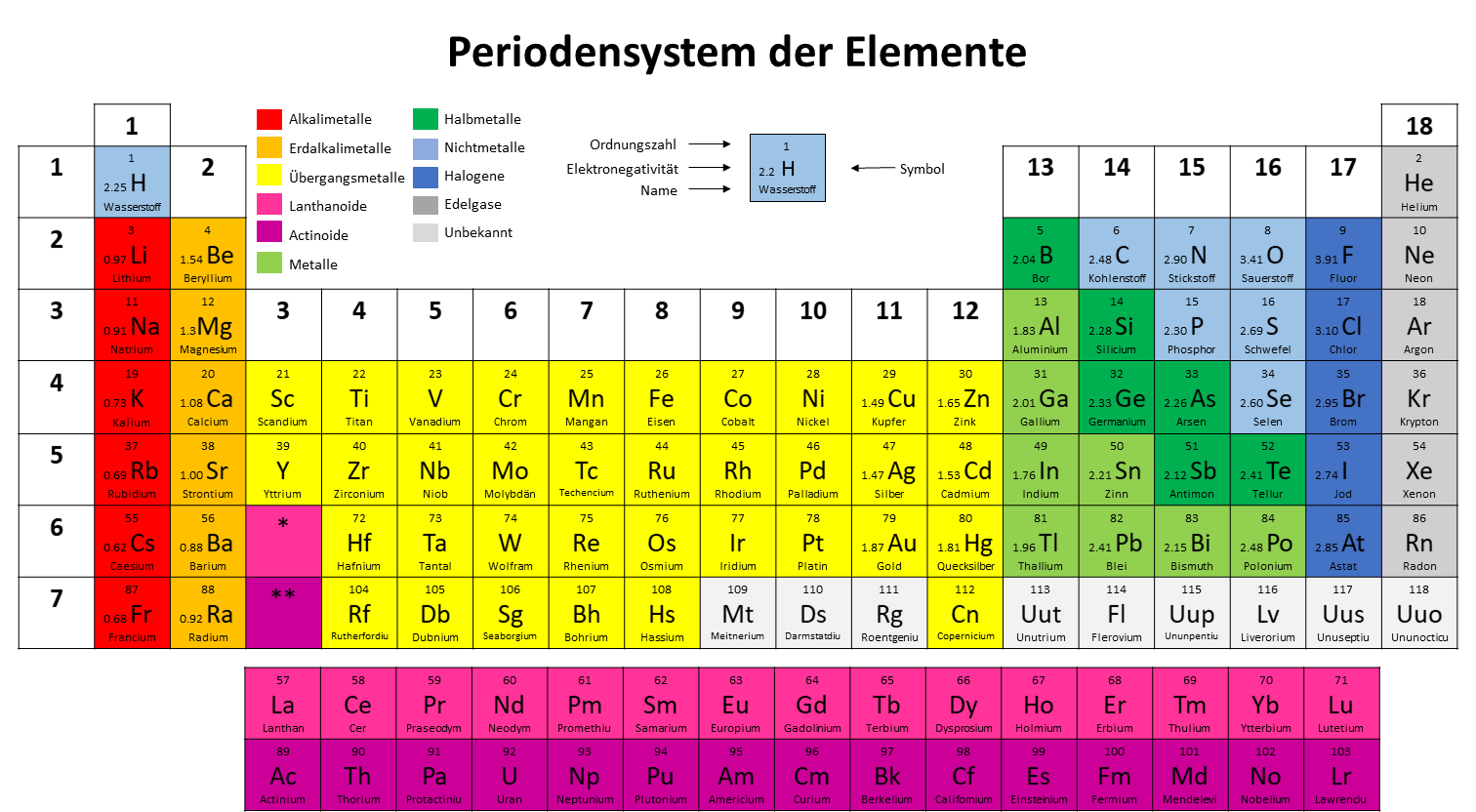
Die Oxidationszahl lässt sich nicht immer mit den eben genannten Regeln bestimmen. In diesem Fall kann sie aber mithilfe der Elektronegativitäten und Gruppen der Elemente bestimmt werden.
Diese können einfach in einem Periodensystem nachgeschaut werden. Dabei betrachten wir hier hauptsächlich die Hauptgruppen (Gruppe 1, 2, 13, 14, 15, 16, 17 und 18).
Bestimmen wir zunächst die Oxidationszahlen aller Elemente im Kaliumchlorat (KClO3). Dazu betrachten wir zunächst die jeweiligen Elektronegativitäten und ordnen dann in jeder Bindung den Elementen mit höherer Elektronegativität eine negative Teilladung (-) und denen mit niedrigerer Elektronegativität eine positive Teilladung (+).
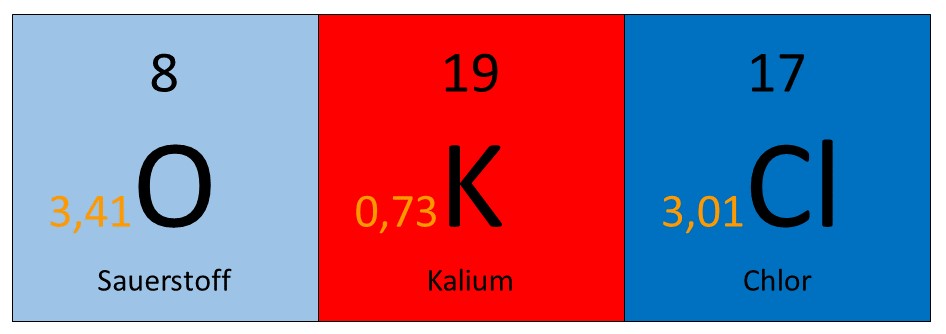
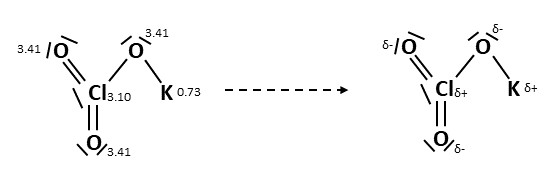
Betrachten wir beispielsweise dieses Molekül, würde man sich zuerst eine beliebige Bindung heraussuchen. Zum Beispiel die Verbindung zwischen und , da kann man sehen, dass die Elektronegativität vom Sauerstoff deutlich höher ist, also erhält der Sauerstoff die negative Teilladung und das Kalium die positive.
So kannst du nach und nach jede Bindung einzeln betrachten und die Teilladungen zu sortieren.
Bedenke, dass es sich bei jeder Verbindungslinie zwischen zwei Elementen um zwei Bindungselektronen handelt.
Außerdem handelt es sich bei den Linien neben den Atomen um zwei freie Elektronen.
Elemente mit negativer Teilladung ziehen nun alle Elektronen aus den Bindungen zu sich. Das lässt sich wie folgt darstellen. Alle rot-markierten Bindungen und freien Elektronenpaare gehören zu den elektronegativeren Sauerstoffatomen.
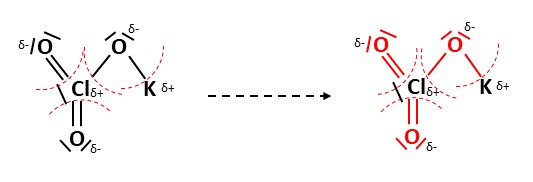
Anhand der Gruppe, in welcher sich das Element befindet, lässt sich die Wertigkeit ablesen. Die Wertigkeit beschreibt die Anzahl der Elektronen, die ein Element im Normalzustand besitzt. Elemente der 1. Hauptgruppe besitzen jeweils die Wertigkeit eins, der 2. Hauptgruppe zwei, der 3. drei und so weiter.
Nun zählen wir einfach ab, wie viele Elektronen zu jedem Element gehören und ziehen das von der Anzahl der Elektronen im Normalzustand ab. So erhalten wir die Oxidationszahl der jeweiligen Elemente.
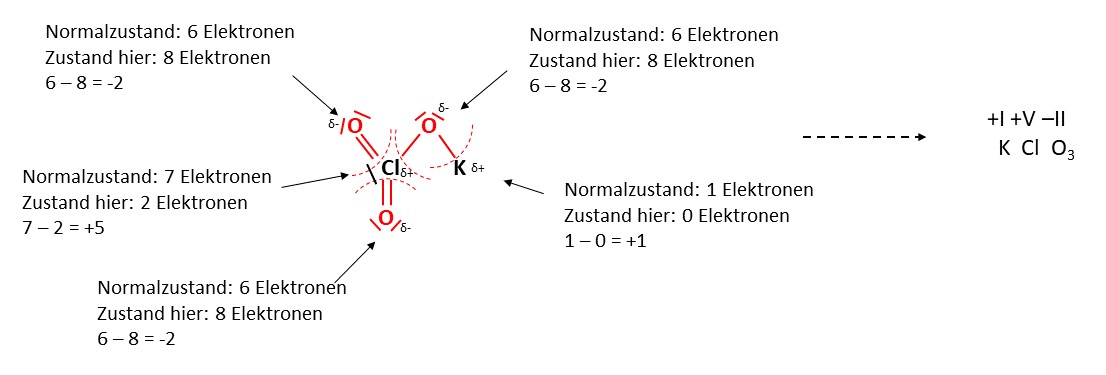
Auf diese Art und Weise können alle Oxidationszahlen bestimmt werden. Für die Verwendung werden Oxidationszahlen als Römische Zahlen über das jeweilige Element geschrieben.
Übrigens! Wenn zwei Elemente einer Bindung dieselbe Elektronegativität haben, teilen sie die Bindungselektronen 1:1 auf.
8 Übungsaufgaben: Oxidationszahlen und Reaktionsarten
Laden
Laden
9 Die Teilgleichungen: Oxidation und Reduktion
Eine Redoxreaktion besteht immer aus zwei Teilreaktionen, der Oxidation und der Reduktion, welche zusammen die Redox-Gesamtgleichung ergeben. In diesem Abschnitt erklären wir dir die Bedeutung der beiden Begriffe und gehen auf das Erstellen der Gleichungen ein.
Oxidation (OZ nimmt zu)
Die Oxidation (Ox.) steht für die Teilreaktion der Elektronenabgabe, bei der ein Stoff oxidiert wird (man bezeichnet diesen als sogenanntes Reduktionsmittel). Er ist ein Elektronendonator.
Reduktion (OZ nimmt ab)
Die Reduktion (Red.) steht für die Teilreaktion der Elektronenaufnahme, bei der ein Stoff reduziert wird (man bezeichnet diesen als sogenanntes Oxidationsmittel. Er ist ein Elektronenakzeptor.
Schematische Vorgehensweise beim Erstellen der Teilgleichungen:
(1) Erstellen einer Summengleichung für die Reaktion.
(2) Bestimmen der Oxidationszahlen.
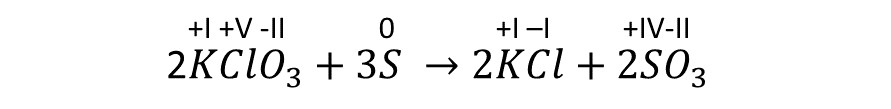
(3) Feststellung der zusammengehörigen RedOx-Paare.
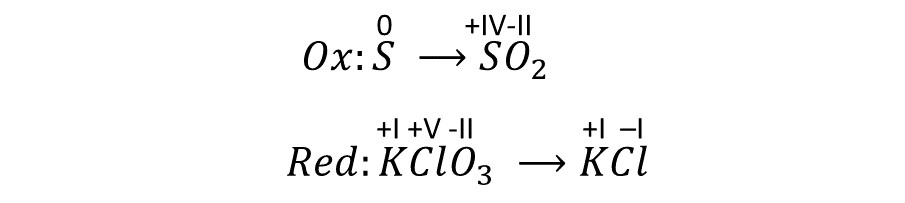
(4) Notieren der abgegebenen und aufgenommenen Elektronen (ableitbar von den Oxidationszahlen).
Bei der Oxidation ändert sich die Ox. Zahl des Schwefelatoms von 0 zu +4 also müssen vier Elektronen zur rechten Seite addiert werden.
Bei der Reduktion ändert sich die Ox. Zahl des Chloratoms von +5 zu -1 also müssen 6 Elektronen zur linken Seite addiert werden.
(5) Reaktionsgleichungen müssen wir mathematische Gleichungen immer ausgeglichen sein. Das nennt man auch Ladungsausgleich.
Ausgeglichen wird dabei, je nach Milieu: im Sauren mit , im Basischen mit . Das Milieu ist dabei bei der Aufgabenstellung meist angegeben, oder es ergibt sich aus den beteiligten Chemikalien.
In unserem Beispiel findet die Reaktion im sauren Milieu statt, da gelöstes Kaliumchlorat () sauer reagiert.
(6) Zuletzt müssen auch die Anzahl der Atome auf beiden Seiten ausgeglichen sein. Das nennt man auch Stoffausgleich. Dieser Ausgleich findet mit Wasser statt.
Nun wissen wir, wie die RedOx-Teilgleichungen aufgestellt werden. Im nächsten Schritt werden diese dann zur Gesamtgleichung zusammengefasst.
10 Übungsaufgaben: Teilgleichungen
Laden
11 Die RedOx-Gesamtgleichung
Der letzte Schritt ist die Vereinigung der Teilgleichungen und das Kürzen zur RedOx-Gesamtgleichung.
Dafür starten wir mit den beiden Teilgleichungen.
Schematische Vorgehensweise beim Erstellen der Gesamtgleichung:
(1) Zuerst müssen die Teilgleichungen ausgeglichen werden, dafür betrachten wir ausschließlich die Anzahl der Elektronen. Diese muss bei beiden Teilgleichungen gleich sein. Dafür berechnet man einfach das kleinste gemeinsame Vielfache (kgV).
In unserem Fall brauchen wir das kgV von 4 und 6, das ist 12. Also müssen wir die Teilnehmer der Oxidation mit 3 multiplizieren und die Reduktion mit 2. Dadurch kommen wir bei beiden Teilgleichungen auf 12 Elektronen.
(2) Danach werden beide Teilgleichungen stumpf addiert.
Diese Gleichung ist nun sehr umfangreich, deswegen wird sie im letzten Schritt noch gekürzt.
(3) Um eine übersichtliche Gleichung zu erhalten, werden alle Teilnehmer gekürzt, welche auf beiden Seiten vorkommen.
12 Übungsaufgaben: RedOx-Gesamtgleichungen
Laden
13 Beispiel für eine RedOx-Reaktion
Laden
Bei der Reaktion im Video handelt es sich ebenfalls um eine RedOx-Reaktion. Im Folgenden wird diese beispielhaft nach dem uns bereits bekannten Schema durchgerechnet.
(1) Summengleichung der Reaktion von Magnesium mit Wasser.
(2) Bestimmung der Oxidationszahlen.
(3) Magnesium wird oxidiert (Veränderung von 0 zu +2), Wasserstoff wird reduziert (Veränderung von +1 zu 0)
(4) Elektronen hinzufügen.
(5) Ladungsausgleich (Basisches Milieu)
(6) Stoffausgleich mit Wasser
(7) Elektronenanzahl ausgleichen. Dieser Schritt kann hier entfallen, da die Anzahl der Elektronen bereits gleich ist.
(8) Addition der Teilgleichungen
(9) Kürzen der Gesamtgleichung
14 Auflösung Feuerwerk
Auflösung Feuerwerk:
Beim klassischen Raketenfeuerwerk werden sehr starke Oxidationsmittel (Chlorate und Nitrate) als auch ebenso starke Reduktionsmittel (Kohlenstoff und Schwefel) verwendet, welche beim Anzünden in einer stark exothermen Reaktion verbrennen. Die jeweilige Farbgebung wird durch das Hinzufügen von verschiedenen Metallsalzen umgesetzt. Einige solche sind Strontiumnitrat, Bariumnitrat, Kaliumnitrat und Kaliumchlorat. Diese sind für die rote, grüne, gelbe und weiße Färbung hauptverantwortlich.
